
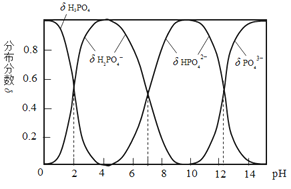
【题目】磷酸(H3PO4)是一种中强酸,常温下,H3PO4水溶液中含磷微粒的分布分数(平衡时某微粒的浓度占各含磷微粒总浓度的分数)与pH的关系如图,下列说法正确的是( )
A.H3PO4的电离方程式为:H3PO4![]() 3H++ PO43
3H++ PO43
B.pH=2时,溶液中大量存在的微粒有:H3PO4、H2PO4、HPO42、PO43
C.滴加NaOH溶液至pH=7,溶液中c(Na+)= c(H2PO4)+2c(HPO42)+3c(PO43)
D.滴加少量Na2CO3溶液,3Na2CO3+2H3PO4 =2Na3PO4+3H2O+3CO2↑
【答案】C
【解析】
观察图可知:随着PH值的增大,水溶液中各种含磷微粒的含量相应的发生改变:PH从0到4,H3PO4含量下降,H2PO4-含量上升,PH=2时,两者浓度相等,其它含磷微粒含量几乎为零;从4到10,H2PO4-含量下降,HPO42-含量上升,PH=7时,两者浓度相等,其它含磷微粒含量几乎为零;pH>10,HPO42-含量下降,PO43-含量上升,PH在虚线所标处两者浓度相等,其它含磷微粒含量几乎为零。根据图中各微粒的分布情况,结合弱电解质的电离,电中性原则及物质的基本性质可对各选项作出判断。
A项、磷酸是三元中强酸,属于弱电解质,电离方程式应分步书写,A选项错误;
B项、由图可知,PH=2时,含磷微粒主要是H3PO4和H2PO4-,其它含量几乎为零,B错;
C项、根据电中性原则有:c(H+)+c(Na+)= c(H2PO4)+2c(HPO42)+3c(PO43)+c(OH-),PH=7时,c(H+)=C(OH-),所以有:c(Na+)= c(H2PO4)+2c(HPO42)+3c(PO43),C正确;
D项、生成二氧化碳的环境为酸性环境,在磷酸中滴加少量碳酸钠溶液得到的含磷产物主要是H2PO4-或HPO42-,D错;
答案选C。


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】对下列叙述的评价合理的是
选项 | 叙述 | 评价 |
A | 乙酸乙酯在H | 对,根据酯的水解规律,产物乙醇中将含有18O同位素,而乙酸则没有 |
B | 明矾和漂白粉都可用于水的净化 | 对,二者的作用原理相同 |
C | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | 对,K2CO3与NH4Cl反应生成氨气会降低肥效 |
D | 可以用新制的Cu(OH)2悬浊液鉴别乙醇、乙酸和葡萄糖 | 错,用新制的Cu(OH)2悬浊液不能鉴别乙醇和乙酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
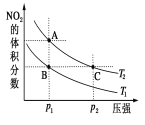
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A、C两点一样颜色
C.由状态A到状态B,可以用降温的方法
D.A、C两点气体的平均相对分子质量:A>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
A | B | C | D |
NaCl溶于水 |
电解CuCl2溶液 |
CH3COOH在水中电离 |
H2与Cl2反应能量变化 |
NaCl | CuCl2 | CH3COOH | H2(g)+Cl2(g) ΔH=183kJ·mol1 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A为正盐,常温、常压下,B、C、D、E、G、H、I均为气体,其中D、G、H为单质,气体B能使湿润红色石蕊试纸变蓝,气体E本身为无色气体,但是与空气接触会生成一种红棕色气体I,H为黄绿色气体。F在常温下是一种无色液体。C、J的水溶液分别为两种强酸。图中反应条件(除加热外)均己略去。
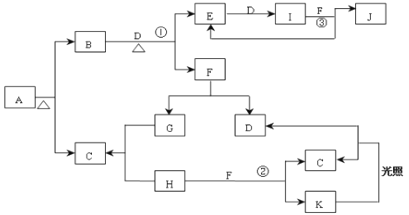
(1)写出它们的化学式:A__、C__、J__。
(2)写出②的离子反应方程式:__。
(3)写出③的化学反应方程式:__。
(4)红热的碳与J的浓溶液反应的化学方程式:__。
(5)J的浓溶液与单质Ag反应的离子方程式为:__。
(6)若86.4g银与含有1.4molJ的浓溶液恰好完全反应,则最终得到气体(NO、NO2)的总物质的量为__mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2SO2+O2![]() 2SO3的叙述不正确的是( )
2SO3的叙述不正确的是( )
A.该反应是可逆反应
B.反应方程式中“![]() ”表示在相同条件下,反应可以同时向两个方向进行
”表示在相同条件下,反应可以同时向两个方向进行
C.1 mol O2与2 mol SO2混合反应,可生成2 mol SO3
D.在该反应中SO2作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极电解饱和食盐水,下列分析错误的是
A.得电子能力H+>Na+,故阴极得到H2
B.水电离平衡右移,故阴极区得到OH-
C.失电子能力Cl->OH-,故阳极得到Cl2
D.OH-向阴极移动,故阳极区滴酚酞不变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体硼熔点为1873K,其结构单元为正二十面体,结构如图所示。氮化硼(BN)有多种相结构,例如六方相氮化硼与立方相氮化硼,结构如图所示,六方相氮化硼与石墨相似,具有层状结构;立方相氮化硼是超硬材料。回答下列问题:
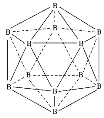
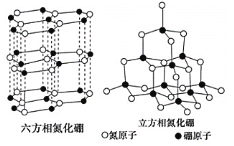
(1)基态硼原子有___种不同能量的电子,第二周期中,第一电离能介于硼元素与氮元素之间的元素有___种。
(2)晶体硼为___(填晶体类型),结构单元由___个硼原子构成,共含有___个B-B键。
(3)关于氮化硼两种晶体的说法,正确的是___。
a.立方相氮化硼含有σ键和π键
b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体均为分子晶体
d.两种晶体中的B-N键均为共价键
(4)NH4BF4是合成氮化硼纳米管的原料之一,1molNH4BF4含有___mol配位键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢、氮、氧、硫,镁,铁、铜,锌等元素及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:
(1)某同学根据已学知识,推断Mg基态原子的核外电子排布为,
![]()
该同学所画的电子排布图违背了________________________________.
(2)Fe位于___________族_______区,Fe2+价电子排布式为_____________。
(3)MgCO3的分解温度____ BaCO3 (填“>” 或、“<”)
(4)C、N、O元素的第一电离能由大到小的顺序为_________________
(5)1mol[Cu(NH3)2]+中含有σ键的数目为___________
(6)下列有关说法不正确的是____。
A.热稳定性:NH3 >PH3,原因是NH3分子间存在氢键,而PH3分子间存在范德华力
B.SO2与CO2的化学性质有些类似,但空间结构与杂化方式不同
C.熔、沸点: SiF4< SiCl4< SiBr4 <SiI4 , 原因是分子中共价键键能逐渐增大
D.熔点: CaO > KCl > KBr,原因是晶格能逐渐减小
(7)晶体Cu的堆积方式如图所示,其中Cu原子在二维平面里放置时的配位数为_________,设Cu原子半径为a,晶体的空间利用率为______。(用含π,a、的式子表示,不必化简)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com