
【题目】如图,将一根较纯的铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重。下列关于此现象的说法错误的是( )
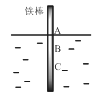
A.该腐蚀过程属于电化腐蚀
B.铁棒AB段电极反应为O2 + 2H2O+ 4e-→ 4OH-
C.铁棒AB段是负极,BC段是正极
D.产生此现象的根本原因是铁棒所处化学环境的不同
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
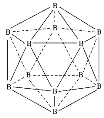
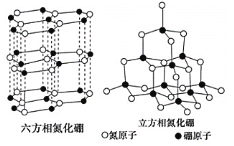
【题目】晶体硼熔点为1873K,其结构单元为正二十面体,结构如图所示。氮化硼(BN)有多种相结构,例如六方相氮化硼与立方相氮化硼,结构如图所示,六方相氮化硼与石墨相似,具有层状结构;立方相氮化硼是超硬材料。回答下列问题:
(1)基态硼原子有___种不同能量的电子,第二周期中,第一电离能介于硼元素与氮元素之间的元素有___种。
(2)晶体硼为___(填晶体类型),结构单元由___个硼原子构成,共含有___个B-B键。
(3)关于氮化硼两种晶体的说法,正确的是___。
a.立方相氮化硼含有σ键和π键
b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体均为分子晶体
d.两种晶体中的B-N键均为共价键
(4)NH4BF4是合成氮化硼纳米管的原料之一,1molNH4BF4含有___mol配位键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢、氮、氧、硫,镁,铁、铜,锌等元素及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:
(1)某同学根据已学知识,推断Mg基态原子的核外电子排布为,
![]()
该同学所画的电子排布图违背了________________________________.
(2)Fe位于___________族_______区,Fe2+价电子排布式为_____________。
(3)MgCO3的分解温度____ BaCO3 (填“>” 或、“<”)
(4)C、N、O元素的第一电离能由大到小的顺序为_________________
(5)1mol[Cu(NH3)2]+中含有σ键的数目为___________
(6)下列有关说法不正确的是____。
A.热稳定性:NH3 >PH3,原因是NH3分子间存在氢键,而PH3分子间存在范德华力
B.SO2与CO2的化学性质有些类似,但空间结构与杂化方式不同
C.熔、沸点: SiF4< SiCl4< SiBr4 <SiI4 , 原因是分子中共价键键能逐渐增大
D.熔点: CaO > KCl > KBr,原因是晶格能逐渐减小
(7)晶体Cu的堆积方式如图所示,其中Cu原子在二维平面里放置时的配位数为_________,设Cu原子半径为a,晶体的空间利用率为______。(用含π,a、的式子表示,不必化简)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂。在NaOH溶液中ClO2与H2O2反应可以得到亚氯酸钠。
(1)在制备亚氯酸钠的反应中ClO2作___(填“氧化剂”或“还原剂”);若反应中生成1 mol NaClO2,转移电子的物质的量为__。
(2)该反应的化学方程式为__。
Ⅱ.有一瓶澄清的溶液,其中可能含有NH4+、K+、Ba2+、Al3+、Fe3+、I-、NO3-、CO32-、SO42-、[Al(OH)4]-。取该溶液进行以下实验:
①用pH试纸检测,溶液呈强酸性。
②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色。
③另取溶液适量,逐滴加入NaOH溶液:
a.溶液从酸性变为中性;
b.溶液中逐渐产生沉淀;
c.沉淀完全溶解;
d.最后加热溶液,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
④取适量③得到的碱性溶液,加入Na2CO3溶液,有白色沉淀生成。
根据上述实验现象,回答下列问题。
(1)由①可以排除___的存在。
(2)由②可以证明___的存在;同时排除___的存在。
(3)由③可以证明___的存在。
(4)由④可以排除SO42-的存在,同时证明Ba2+的存在。
(5)写出c、d所涉及的化学方程式,是离子反应的用离子方程式表示:
c.___;
d.___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中无机氮的循环过程可用如图表示。下列说法正确的是(已知:反应④的离子方程式为4NH4+ + 5O2![]() 2NO2- + 6H+ + N2O + 5H2O)
2NO2- + 6H+ + N2O + 5H2O)

A. ①②均属于固氮反应
B. 海洋中的反硝化作用一定需要氧气参加
C. 反应④中每生成1 mol H2O转移2 mol e-
D. 向海洋排放含NO3-的废水可能影响海洋中氮的循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是( )
A. 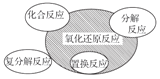 四种基本反应类型与氧化还原反应的关系
四种基本反应类型与氧化还原反应的关系
B.  AlCl3溶液中滴加NaOH溶液生成沉淀的情况
AlCl3溶液中滴加NaOH溶液生成沉淀的情况
C.  Ba(OH)2溶液中滴加硫酸溶液导电性的情况
Ba(OH)2溶液中滴加硫酸溶液导电性的情况
D.  等体积、等浓度稀硫酸分别与足量铁和镁反应的情况
等体积、等浓度稀硫酸分别与足量铁和镁反应的情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐卤中除含有Mg2+、Cl﹣外,还含有少量Na+、Fe2+、Fe3+、SO42﹣和CO(NH2)2等.从海水提取食盐和Br2后的盐卤中可以提取MgCl2、MgO、Mg(OH)2等物质,制备流程如图所示:
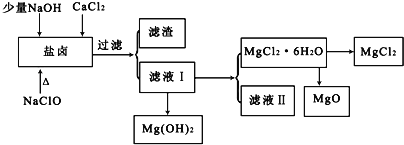
(1)从MgCl2溶液得到MgCl2.6H2O晶体的过程中所需的基本操作顺序依次为__________;
A 加热蒸馏 B 加热浓缩 C 冷却结晶 D 趁热过滤 E 过滤洗涤
(2)制取无水氯化镁必须在氯化氢存在的条件下进行,原因是___________(用适当的文字结合化学用语说明).
(3)用NaClO除去尿素CO(NH2)2时,生成物除盐外,都是能参与大气循环的物质,则该反应的化学方程式为___________;加入NaClO的另一个作用是___________.
(4)Mg(OH)2是制镁盐、耐火材料和阻燃剂的重要原料。
已知25℃时Ksp[Mg(OH)2]=5.6×10﹣12,且Mg(OH)2(s)═MgO(s)+H2O(s)△H=+81.5kJ/mol。
①下列叙述正确的是______
A.从盐卤或海水中获得Mg(OH)2,工业上选择NaOH作沉淀剂
B.Mg(OH)2能作阻燃剂的原因是它分解吸热且生成MgO覆盖可燃物
C.可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁
②酸碱指示剂百里酚蓝变色的pH范围如下:
pH | <8.0 | 8.0~9.6 | >9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
25℃时,在Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以黄铜矿(主要成分CuFeS2)为原料制备金属铜,有如下两种工艺。
I.火法熔炼工艺:将处理过的黄铜矿加入石英,再通入空气进行焙烧,即可制得粗铜。
(1)焙烧的总反应式可表示为:2CuFeS2+ 2SiO2+5O2=2Cu+2FeSiO3+4SO2该反应的氧化剂是___________。
(2)下列处理SO2的方法,不合理的是_____
A高空排放 B用纯碱溶液吸收制备亚硫酸钠
C用氨水吸收后,再经氧化制备硫酸铵 D用BaCl2溶液吸收制备BaSO3
(3)炉渣主要成分有FeO 、Fe2O3 、SiO2、Al2O3等,为得到Fe2O3加盐酸溶解后,后续处理过程中未涉及到的操作有____________。
A过滤 B加过量NaOH溶液 C蒸发结晶 D灼烧 E加氧化剂
II.FeCl3溶液浸取工艺:其生产流程如下图所示
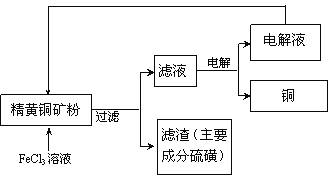
(4)浸出过程中,CuFeS2与FeCl3溶液反应的离子方程式为_____________。
(5)该工艺流程中,可以循环利用的物质是____ (填化学式)。
(6)若用石墨电极电解滤液,写出阳极的电极反式_____________。
(7)黄铜矿中含少量Pb,调节C1一浓度可控制滤液中Pb2+的浓度,当c(C1一)=2mo1·L-1时溶液中Pb2+物质的量浓度为___mol·L-1。[已知KSP(PbCl2)=1 x 10一5]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素是构成我们生活的世界中一切物质的“原材料”。
Ⅰ.1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如图所示。
Ni=Co=59 | |||||
H=1 | Cu=63.4 | Ag=108 | Hg=200 | ||
Be=9.4 | Mg=24 | Zn=65.2 | Cd=112 | ||
B=11 | Al=27.4 | ?=68 | Ur=116 | Au=198? | |
C=12 | Si=28 | ?=70 | Sn=118 | ||
N=14 | P=31 | As=75 | Sb=122 | Bi=210? | |
O=16 | S=32 | Se=79.4 | Te=128? | ||
F=19 | Cl=35.5 | Br=80 | I=127 | ||
Li=7 | Na=23 | K=39 | Rb=85.4 | Cs=133 | Tl=204 |
Ca=40 | Pb=207 |
(1)门捷列夫将已有元素按照相对原子质量排序,同一___(填“横行”或“纵列”)元素性质相似。
(2)结合表中信息,猜想第5列方框中“Te=128?”的问号表达的含义是___。
Ⅱ.X、Y、Z、W是现在元素周期表中的短周期元素,它们的相对位置如图所示,其中Y元素原子核外最外层电子数是其电子层数的3倍。
X | Y | |
Z | W |
请回答下列问题:
(1)W位于周期表中的位置__。W的原子核外电子运动状态有___种,原子轨道数为___。
(2)比较Y、Z气态氢化物的稳定性___(用分子式表示)。
(3)科学家们认为存在含氢量最高的化合物XH5,预测其与水剧烈反应放出气体,所得水溶液呈弱碱性,写出该反应的化学方程式___,XH5是离子化合物,它的电子式为___。
(4)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com