
【题目】元素是构成我们生活的世界中一切物质的“原材料”。
Ⅰ.1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如图所示。
Ni=Co=59 | |||||
H=1 | Cu=63.4 | Ag=108 | Hg=200 | ||
Be=9.4 | Mg=24 | Zn=65.2 | Cd=112 | ||
B=11 | Al=27.4 | ?=68 | Ur=116 | Au=198? | |
C=12 | Si=28 | ?=70 | Sn=118 | ||
N=14 | P=31 | As=75 | Sb=122 | Bi=210? | |
O=16 | S=32 | Se=79.4 | Te=128? | ||
F=19 | Cl=35.5 | Br=80 | I=127 | ||
Li=7 | Na=23 | K=39 | Rb=85.4 | Cs=133 | Tl=204 |
Ca=40 | Pb=207 |
(1)门捷列夫将已有元素按照相对原子质量排序,同一___(填“横行”或“纵列”)元素性质相似。
(2)结合表中信息,猜想第5列方框中“Te=128?”的问号表达的含义是___。
Ⅱ.X、Y、Z、W是现在元素周期表中的短周期元素,它们的相对位置如图所示,其中Y元素原子核外最外层电子数是其电子层数的3倍。
X | Y | |
Z | W |
请回答下列问题:
(1)W位于周期表中的位置__。W的原子核外电子运动状态有___种,原子轨道数为___。
(2)比较Y、Z气态氢化物的稳定性___(用分子式表示)。
(3)科学家们认为存在含氢量最高的化合物XH5,预测其与水剧烈反应放出气体,所得水溶液呈弱碱性,写出该反应的化学方程式___,XH5是离子化合物,它的电子式为___。
(4)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式___。
【答案】横行 怀疑Te的相对原子质量(或同一列相对原子质量依次增大,按此规律,Te的相对原子质量应该在122和127之间) 第三周期第ⅦA族 17 9 H2S<H2O NH5+H2O=H2↑+NH3·H2O  2S2Cl2+2H2O═3S↓+SO2↑+4HCl
2S2Cl2+2H2O═3S↓+SO2↑+4HCl
【解析】
Ⅰ.(1)结合表中给出的是相对原子质量分析;
(2)由表中信息,同一列相对原子质量依次增大;
Ⅱ.X、Y、Z、W是现在元素周期表中的短周期元素,由元素在周期表中位置,可知X、Y处于第二周期,Z、W处于第三周期,其中Y元素原子核外最外层电子数是其电子层数的3倍,最外层电子数为6,故Y为氧元素,则Z为硫元素、X为氮元素、W为Cl;
(2)元素非金属性越强,对应氢化物越稳定;
(3)化合物NH5与水剧烈反应放出气体,所得水溶液呈弱碱性,水溶液为氨水,相当于反应生成氨气后再溶于水,由元素守恒可知反应时放出的气体为氢气,NH5是离子化合物,N原子形成稳定结构最多形成4个N-H键,由铵根离子与氢负离子构成;
(4)S2Cl2可与水反应生成一种能使品红溶液褪色的气体,该气体为SO2,其中只有一种元素化合价发生改变,故S元素化合价降低,根据电子转移守恒计算生成二氧化硫的物质的量,再根据元素守恒计算发生还原反应的S原子物质的量,再根据电子转移守恒计算硫元素在氧化产物中的化合价确定氧化产物,最后结合原子守恒进行解答。
Ⅰ.(1)结合表中信息得,给出的是元素的相对原子质量,故同一横行元素性质相似;
(2)由表中信息,同一列按相对原子质量依次增大规律进行排列,第5列方框中“Te=128?”的问号表示 怀疑Te的相对原子质量,Te的相对原子质量应该在122和127之间;
Ⅱ.X、Y、Z、W是现在元素周期表中的短周期元素,由元素在周期表中位置,可知X、Y处于第二周期,Z、W处于第三周期,其中Y元素原子核外最外层电子数是其电子层数的3倍,最外层电子数为6,故Y为氧元素,则Z为硫元素、X为氮元素、W为Cl;
(1)W为Cl,在周期表中的位置:第三周期第ⅦA族;Cl元素的核电荷数是17,则原子核外电子总数为17,即W的原子核外电子运动状态有17种,其电子排布式为1s22s22p63s23p5,则原子轨道数为9;
(2)由于元素非金属性S<O,故氢化物稳定性:H2S<H2O;
(3)化合物NH5与水剧烈反应放出气体,所得水溶液呈弱碱性,水溶液为氨水,相当于反应生成氨气后再溶于水,由元素守恒可知反应时放出的气体为氢气,反应方程式为NH5+H2O=H2↑+NH3H2O,NH5是离子化合物,N原子形成稳定结构最多形成4个N-H键,由铵根离子与氢负离子构成,电子式为: ;
;
(4)化合物S2Cl2可与水反应生成一种能使品红溶液褪色的气体,该气体为SO2,其中只有一种元素化合价发生改变,故S元素化合价降低,根据电子转移守恒,转移0.3mol电子生成二氧化硫为![]() =0.1mol,故有0.3molS原子发生还原反应,根据电子转移守恒可知S元素在还原产物中的化合价为0,故生成S,同时生成HCl,该反应的化学方程式为2S2Cl2+2H2O═3S↓+SO2↑+4HCl。
=0.1mol,故有0.3molS原子发生还原反应,根据电子转移守恒可知S元素在还原产物中的化合价为0,故生成S,同时生成HCl,该反应的化学方程式为2S2Cl2+2H2O═3S↓+SO2↑+4HCl。


科目:高中化学 来源: 题型:
【题目】如图,将一根较纯的铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重。下列关于此现象的说法错误的是( )
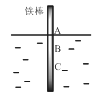
A.该腐蚀过程属于电化腐蚀
B.铁棒AB段电极反应为O2 + 2H2O+ 4e-→ 4OH-
C.铁棒AB段是负极,BC段是正极
D.产生此现象的根本原因是铁棒所处化学环境的不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚维酮碘的水溶液是一种常用的碘伏类缓释消毒剂,聚维酮通过氢键与HI3形成聚维酮碘,其结构表示如图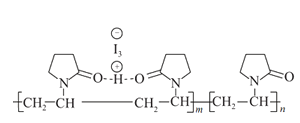 ,下列说法不正确的是( )
,下列说法不正确的是( )
A.聚维酮的单体是![]() B.聚维酮分子由(m+n)个单体聚合而成
B.聚维酮分子由(m+n)个单体聚合而成
C.聚维酮碘是一种水溶性物质D.聚维酮在一定条件下能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A、B、C、D都是短周期元素,A元素原子的2p轨道上仅有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是同周期中电负性最大的,D的气态氢化物的水溶液能使无色酚酞试液变红。试回答:
(1)A的最外层电子轨道排布图为___;B的电子排布式为___;C的最外层电子排布式为__;D的原子结构示意图为___。
(2)D与H原子形成的某气态化合物溶于水能使酚酞溶液变红,请解释原因:__。已知D与H原子能形成一种高能量的分子D2H2,其中D原子满足8电子结构特征,则该分子的电子式为___。
(3)B的原子核外电子运动状态有__种,原子轨道数为__,有__种能量不同的电子,电子占据的最高能量的电子层符号为__。
(4)四种元素最高价氧化物水化物酸性由强到弱的是(用对应化学式回答)__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是制取饮料、香精、染料、涂料、洗涤剂等产品的原料。
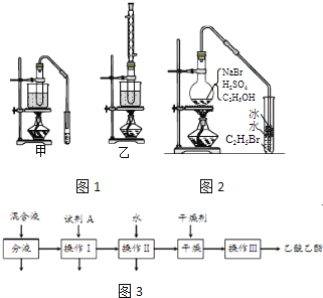
完成下列填空:
(1)实验室用乙醇制取乙烯时,浓硫酸的用量远远超过作为催化剂的正常用量,原因是______。
(2)验证乙烯加成反应性质时,需对乙烯气体中的干扰物质进行处理,可选用的试剂是_____(填写化学式);能确定乙烯通入溴水中发生了加成反应的事实是______。(选填编号)
a.溴水褪色 b.有油状物质生成
c.反应后水溶液酸性增强 d.反应后水溶液接近中性
(3)实验室用乙醇和乙酸制备乙酸乙酯时,甲、乙两套装置如图1都可以选用。关于这两套装置的说法正确的是______。(选填编号)

a.甲装置乙酸转化率高 b.乙装置乙酸转化率高
c.甲装置有冷凝回流措施 d.乙装置有冷凝回流措施
(4)用乙装置实验时,提纯乙中乙酸乙酯的流程如图3以上流程中试剂A的化学式是______;操作Ⅱ的名称是______;操作Ⅲ一般适用于分离______混合物。
(5)如图2是用乙醇制备溴乙烷的装置,实验中有两种加料方案:
①先加溴化钠→再加乙醇→最后加1:1浓硫酸;
②先加溴化钠→再加1:1浓硫酸→最后加乙醇。
按方案①和②实验时,产物都有明显颜色,若在试管中加入______,产物可变为无色。与方案①相比较,方案②的明显缺点是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是( )
选项 | 微粒组 | 所加试剂 | 离子方程式 |
A | NH | 少量Ba(OH)2溶液 | 2NH |
B | Mg2+、Cl-、HCO | 过量NaOH溶液 | Mg2++2HCO |
C | Fe2+、NO | NaHSO4溶液 | HSO |
D | K+、CO | 通入少量CO2 | CO |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaOH溶液清洗试管壁上的硫,发生反应S+NaOH—Na2SO3+Na2S+H2O(未配平)。下列说法不正确的是
A.方程式中含钠元素的化合物均含离子键和共价键
B.生成的Na2SO3 和Na2S的物质的量之比为1 : 2
C.方程式中S和H2O的化学计量数相同
D.清洗之后的废液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO和H2生产燃料甲醇。一定条件下密闭容器中发生反应,测得数据曲线如下图所示(反应混合物均呈气态)。下列说法错误的是
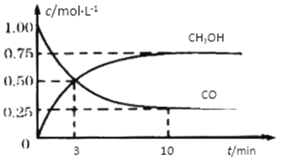
A.反应的化学方程式:CO+2H2![]() CH3OH
CH3OH
B.反应进行至3分钟时,正、逆反应速率相等
C.反应至10分钟,(CO) = 0.075 mol/L·min
D.增大压强,平衡正向移动,K不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。
SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。
完成下列填空。
(1)该反应中被氧化的元素是_____;写出该反应的平衡常数表达式:K=_____。
(2)若将NO2(g)和SO2(g)置于一密闭容器中进行上述反应。下列说法能表明反应达到平衡状态的是______(选填编号)。
a.混合气体颜色保持不变 b.NO2和NO的体积比保持不变
c.每消耗1mol SO2的同时生成1mol SO3 d.体系中气体密度保持不变
(3)一定温度下,在容积为V L的容器中发生上述反应,t min内,SO2的物质的量下降了a mol,则这段时间内v(NO)=_______(用相关字母表示并注明单位)。
(4)请写出两种能提高SO2转化率的措施:_________。
(5)亚硫酸溶液久置,pH会变小,请用化学方程式表示其原因___。
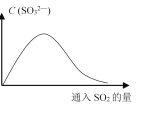
(6)将SO2持续通入NaOH溶液中,溶液中SO32-的浓度变化如图所示,请解释原因。__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com