
【题目】盐卤中除含有Mg2+、Cl﹣外,还含有少量Na+、Fe2+、Fe3+、SO42﹣和CO(NH2)2等.从海水提取食盐和Br2后的盐卤中可以提取MgCl2、MgO、Mg(OH)2等物质,制备流程如图所示:
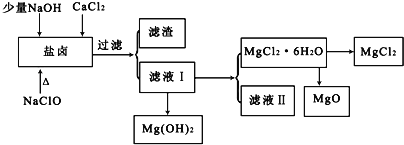
(1)从MgCl2溶液得到MgCl2.6H2O晶体的过程中所需的基本操作顺序依次为__________;
A 加热蒸馏 B 加热浓缩 C 冷却结晶 D 趁热过滤 E 过滤洗涤
(2)制取无水氯化镁必须在氯化氢存在的条件下进行,原因是___________(用适当的文字结合化学用语说明).
(3)用NaClO除去尿素CO(NH2)2时,生成物除盐外,都是能参与大气循环的物质,则该反应的化学方程式为___________;加入NaClO的另一个作用是___________.
(4)Mg(OH)2是制镁盐、耐火材料和阻燃剂的重要原料。
已知25℃时Ksp[Mg(OH)2]=5.6×10﹣12,且Mg(OH)2(s)═MgO(s)+H2O(s)△H=+81.5kJ/mol。
①下列叙述正确的是______
A.从盐卤或海水中获得Mg(OH)2,工业上选择NaOH作沉淀剂
B.Mg(OH)2能作阻燃剂的原因是它分解吸热且生成MgO覆盖可燃物
C.可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁
②酸碱指示剂百里酚蓝变色的pH范围如下:
pH | <8.0 | 8.0~9.6 | >9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
25℃时,在Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为___________.
【答案】BCE 防止Mg2+水解,Mg2++2H2O Mg(OH)2+2H+ 3NaClO+CO(NH2)2═3NaCl+CO2↑+N2↑+2H2O
或NaOH+3NaClO+ CO(NH2)2═3NaCl+NaHCO3+N2↑+2H2O 氧化Fe2+使它变成Fe(OH)3沉淀而除去 B 蓝色
【解析】
向盐卤溶液中加入NaClO,NaClO具有强氧化性,能将Fe2+氧化为Fe3+,向盐卤中加入少量NaOH,NaOH和Fe3+反应生成Fe(OH)3,CO(NH2)2和NaClO发生氧化还原反应,生成物除盐外,都是能参与大气循环的物质,所以生成物是NaCl、CO2、N2、H2O,过量二氧化碳能和NaOH反应生成碳酸氢钠,将溶液过滤得到的滤渣是Fe(OH)3,滤液I中含有Mg2+、Cl﹣、Na+,将滤液I蒸发、结晶、过滤得到MgCl26H2O,则滤液中含有的杂质离子是Na+,直接将MgCl26H2O加强热能得到MgO,发生反应MgCl26H2O![]() MgO+2HCl↑+5H2O↑,氯化镁易水解,所以不能用加热MgCl26H2O方法制取氯化镁,要在HCl氛围中制取氯化镁。
MgO+2HCl↑+5H2O↑,氯化镁易水解,所以不能用加热MgCl26H2O方法制取氯化镁,要在HCl氛围中制取氯化镁。
(1)从MgCl2溶液得到MgCl2.6H2O晶体的过程,加热浓缩、冷却结晶、过滤洗涤,所以选择BCE。
(2)直接将MgCl26H2O加强热能得到MgO,同时还生成HCl和水蒸气,反应方程式为MgCl26H2O![]() MgO+2HCl↑+5H2O↑,氯化镁易水解,为防止氯化镁水解,在制取氯化镁时,要将MgCl26H2O放在氯化氢气体中,防止Mg2+水解,Mg2++2H2O Mg(OH)2+2H+。
MgO+2HCl↑+5H2O↑,氯化镁易水解,为防止氯化镁水解,在制取氯化镁时,要将MgCl26H2O放在氯化氢气体中,防止Mg2+水解,Mg2++2H2O Mg(OH)2+2H+。
(3)通过以上分析知,该反应为3NaClO+CO(NH2)2═3NaCl+CO2↑+N2↑+2H2O或NaOH+3NaClO+ CO(NH2)2═3NaCl+NaHCO3+N2↑+2H2O,次氯酸钠具有强氧化性,能将亚铁离子氧化为铁离子,再转化为氢氧化铁沉淀而除去。
(4)①A、从盐卤或海水中获得Mg(OH)2,工业上选择生石灰作沉淀剂,故A错误;B、Mg(OH)2分解吸热,且MgO不能燃烧,所以Mg(OH)2能作阻燃剂是它分解吸热且生成MgO覆盖可燃物,故B正确;C、MgO熔点太高,工业上电解氯化镁制取镁,故C错误;故答案为B;②25℃时,Mg(OH)2的溶度积Ksp=5.6×10﹣12,根据反应Mg(OH)2(s)Mg2++2OH﹣可得:c(Mg2+)c2(OH﹣)=5.6×10﹣12,
设c(OH﹣)=2c(Mg2+)=x,则:0.5x×x2=5.6×10﹣12,
解得:x=2.24×10﹣4mol/L,
c(H+)=![]() mol/L=4.5×10﹣11mol/L,
mol/L=4.5×10﹣11mol/L,
溶液的pH=10.4>9.6,所以溶液呈蓝色。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
【题目】为了确认乙酸、碳酸和硅酸的酸性强弱,有人设计用如图所示装置,一次实验达到目的(不能再选用其他酸性溶液)。

(1)锥形瓶内装有某种可溶性正盐固体(含有3种酸的酸根的其中一种),此固体为________,分液漏斗中所盛试剂是___。
(2)装置B中所盛试剂的名称是________,试剂的作用是__________。
(3)装置C中出现的现象是__________________。
(4)由实验可知三种酸的酸性大小顺序为________(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色稀溶液X中,可能含有下表所列离子中的某几种。
阴离子 | CO |
阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y体积(V)的关系如图所示,下列说法正确的是( )
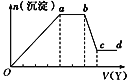
A.若Y是盐酸,则Oa段转化为沉淀的离子(上表中,下同)只有[Al(OH)4]-
B.若Y是盐酸,则溶液中可能含有的阳离子是Al3+
C.若Y是NaOH溶液,则bc段反应的离子方程式为Al(OH)3+OH-=[Al(OH)4]-
D.若Y是NaOH溶液,则X溶液中只存在四种离子,是Al3+、Fe3+、NH4+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,将一根较纯的铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重。下列关于此现象的说法错误的是( )
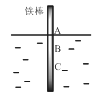
A.该腐蚀过程属于电化腐蚀
B.铁棒AB段电极反应为O2 + 2H2O+ 4e-→ 4OH-
C.铁棒AB段是负极,BC段是正极
D.产生此现象的根本原因是铁棒所处化学环境的不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示表示页岩气中某些烃类的结构模型:

(1)有机物甲的名称为____________,有机物甲与有机物乙互为____________。
(2)有机物乙的一氯取代物有________种,请你根据甲烷分子结构示意图推测,有机物乙中最多有________个C原子在同一平面内。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修2:化学与技术】粉煤灰是燃煤电厂排出的主要固体废物。我国火电厂粉煤灰的主要氧化物组成为:SiO2、Al2O3、CaO等。一种利用粉煤灰制取氧化铝的工艺流程如下:
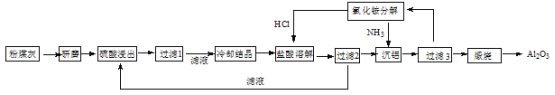
(1)粉煤灰研磨的目的是 。
(2)第1次过滤滤渣的主要成分有 和 (填化学式, 下同),第3次过滤时,滤渣的成分的是 。
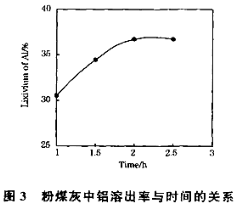
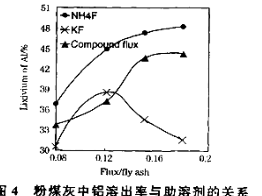
(3)在104℃用硫酸浸取时,铝的浸取率与时间的关系如下图1,适宜的浸取时间为 h;铝的浸取率与“助溶剂/粉煤灰”的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及其NH4F与KF的混合物,在助溶剂/粉煤灰相同时,浸取率最高的是 (填化学式);用含氟的化合物作这种助溶剂缺点是 (举一例)。
(4)流程中循环使用的物质有 和 (填化学式)。
(5)用盐酸溶解硫酸铝晶体,能够发生的原因是 。
(6)用粉煤灰制取含铝化合物的主要意义是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。
SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。
完成下列填空。
(1)该反应中被氧化的元素是_____;写出该反应的平衡常数表达式:K=_____。
(2)若将NO2(g)和SO2(g)置于一密闭容器中进行上述反应。下列说法能表明反应达到平衡状态的是______(选填编号)。
a.混合气体颜色保持不变 b.NO2和NO的体积比保持不变
c.每消耗1mol SO2的同时生成1mol SO3 d.体系中气体密度保持不变
(3)一定温度下,在容积为V L的容器中发生上述反应,t min内,SO2的物质的量下降了a mol,则这段时间内v(NO)=_______(用相关字母表示并注明单位)。
(4)请写出两种能提高SO2转化率的措施:_________。
(5)亚硫酸溶液久置,pH会变小,请用化学方程式表示其原因___。
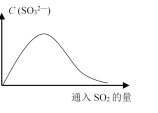
(6)将SO2持续通入NaOH溶液中,溶液中SO32-的浓度变化如图所示,请解释原因。__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚维酮碘的水溶液是一种常用的碘伏类缓释消毒剂,聚维酮通过氢键与HI3形成聚维酮碘,其结构表示如图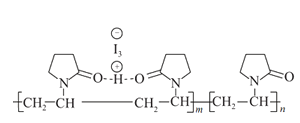 ,下列说法不正确的是( )
,下列说法不正确的是( )
A.聚维酮的单体是![]() B.聚维酮分子由(m+n)个单体聚合而成
B.聚维酮分子由(m+n)个单体聚合而成
C.聚维酮碘是一种水溶性物质D.聚维酮在一定条件下能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaOH溶液清洗试管壁上的硫,发生反应S+NaOH—Na2SO3+Na2S+H2O(未配平)。下列说法不正确的是
A.方程式中含钠元素的化合物均含离子键和共价键
B.生成的Na2SO3 和Na2S的物质的量之比为1 : 2
C.方程式中S和H2O的化学计量数相同
D.清洗之后的废液呈碱性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com