
����Ŀ����֪��25��ʱ��0.1mol��L-lCH3COOH�ĵ���ȣ��ѵ����CH3COOH������/ԭCH3COOH����������ԼΪ1%�����¶��£���0.1000mol��L-l��ˮ�ζ�10.00 mL0.1000mol��L-lCH3COOH��Һ����Һ��pH����Һ�ĵ���������I���Ĺ�ϵ��ͼ��ʾ������˵����ȷ����

A. M���N�㣬ˮ�ĵ���̶�������
B. 25��ʱ��CH3COOH �ĵ��볣��ԼΪ1.0��10-2
C. N����Һ�У�c(CH3COO-) =c(NH4+)=0.05 mol��L-l
D. ������20 mL��ˮʱ����Һ��c(CH3COO-)>c(NH4+)
���𰸡�A
��������A��M���N�㣬M����Ҫ�Ǵ��ᣬ����ˮ���룬N����Ҫ�Ǵ���泥��ٽ�ˮ���룬ˮ�ĵ���̶�������A��ȷ��B��25��ʱ��CH3COOH �ĵ��볣��ԼΪk=0.1*1%*0.1*1%=1.0��10-6,��B����C��N����Һ�У�CH3COO-��NH4+����Ҫˮ�⣬��pHΪ7ʱ��c(CH3COO-) =c(NH4+)<0.05 mol��L-l����C����D��������20 mL��ˮʱ����Һ������Ϊ����狀Ͱ�ˮ������c(CH3COO-)+c(OH+)=c(NH4+)+c(H+),��Һ�ʼ��ԣ�����c(CH3COO-)<c(NH4+)����D����ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС���������������������װ��������ͼ��ʾ�����û������Ʊ�����ϩ��
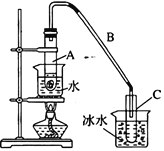
��֪��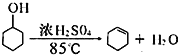
��Է������� | �ܶ�/g cm-3 | �۵�/�� | �е�/�� | �ܽ��� | |
������ | 100 | 0.96 | 25 | 161 | ������ˮ |
����ϩ | 82 | 0.81 | -103 | 83 | ������ˮ |
��1���Ʊ���Ʒ
��12.5 mL��������1mLŨ��������Թ�A�У�ҡ�Ⱥ�������Ƭ��������������Ӧ��ȫ�����Թ�C�ڵõ�����ϩ��Ʒ��
�����Թ��л�ϻ��Ѵ���Ũ�������ʱ������ҩƷ���Ⱥ�˳��Ϊ_________��
���������һ��ʱ��������Ǽ����Ƭ��Ӧ�ò�ȡ����ȷ������_________������ĸ����
A.�������� B.��ȴ�� C.���貹�� D.��������
�����Թ�C���ڱ�ˮ�е�Ŀ����_______________________________��
��2���Ʊ���Ʒ
������ϩ��Ʒ�к��л������������������ʵȡ����Ʒ�м��뱥��ʳ��ˮ�������á��ֲ㣬����ϩ��__________________��(��ϡ����¡�)����Һ����__________________������ĸ��ϴ����
a.����KMnO4��Һ b.ϡ���� c.Na2CO3��Һ
���ٽ��ᴿ��Ļ���ϩ����ͼ��ʾװ�ý�������ͼ������a ��������_______________��ʵ������ȴˮ��__________������ĸ���ڽ��롣����ʱҪ������ʯ�ң�Ŀ����__________________________��
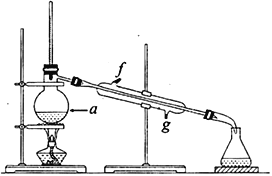
��3�������Ʊ���Ʒʱ���Ѵ����Ʒһ����������ʵ���ƵõĻ���ϩ��Ʒ����__________(�������������� ������)���۲�������ʵ�����õ��Ļ���ϩ����Ϊ6.25g���������___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ÿ��ͨ������ý������ᷢ������Ⱦ��Ũ��Ϊ��ȷ��������������Ϣ����Щ��Ⱦ���ǣ� ��
A.�������������������
B.�������������һ����̼
C.�������������������
D.ϡ�����塢�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20 mL 0.1 mol��L-1����������μ���0.1 mol��L-1�İ�ˮ����ҺpH�ı仯����백ˮ�������ϵ��ͼ��ʾ������������ȷ����
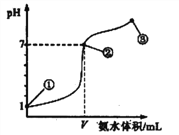
A. V=20mL
B. �ڵ����ʾ��Һ�У�c(Cl-)=c(H+)
C. �ڵ����ʾ��Һ�У�c(H+)=c(NH3��H2O)+c(OH-)
D. �ڵ������֮����ܴ��ڣ�c(NH4+)>c(Cl-)=c(OH-)>c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڵ����ʵ�������������ǣ� ��
A. ����Ѫ���к��н�ϸ�����ڵĵ����� B. DNA�͵�������Ⱦɫ�����ɳɷ�
C. rRNA�ܲ��뵰���ʵ�����ϳ� D. �������Ϻϳɵĵ����ʲ�����ϸ���˷�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ڹ�ҵ����������Ҫ��;��ij�������ϵijɷ�ΪV2O5��V2O4��SiO2��Fe2O3��Al2O3��ʵ��С������л���V2O5��һ�ֹ����������£�
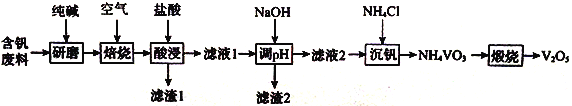
��ش��������⣻
��1������ĥ����Ŀ��Ϊ__________________�����Ӵ���˹���̫�࣬����Ϊ_________��
��2�������ա������û�����г���Na2CO3��NaVO3��Fe2O3��NaA1O2�⣬������________���ѧʽ����
��3���������ʱ��VO3-ת��ΪVO2+��ת����Ӧ�����ӷ���ʽΪ_________________________������1����Ҫ�ɷ�Ϊ_________________���ѧʽ����
��4����֪�������£�Al(OH)3��Fe(OH)3 ������Һ�н���������Ũ�ȵĸ�����[-lg c(M3+ )]��pH �Ĺ�ϵ��ͼ��ʾ��
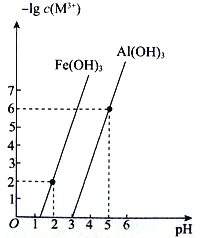
�����£�Ksp[Fe(OH)3]=________________________������pH=4 ʱ����Һ��A13+________��������������������������ȫ������֪����Һ������Ũ��С�ڵ���10-5mol��L-1ʱ����Ϊ�����ӳ�����ȫ��
��5�������ա�ʱ����Ӧ�Ļ�ѧ����ʽΪ____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͨ������ˮ�ࡢ��ͨ��������Ҫԭ���У���ͬ���ǣ� ��
A.���
B.����
C.ʯ��ʯ
D.ʯӢ��SiO2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ƥ�ڷ������ⸯʴʱ��0.2mol����ת�ƣ�����˵����ȷ���ǣ�������
A. ��5.6 g��������ʴ
B. ��6.5 g����������
C. ��0.15 mol����ʧȥ����
D. ��״������4.48 L H2�ݳ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ�������һ�����ڱʺ�������Ȥζʵ�顣��ֽ�����Ȼ��ơ���ɫ��̪�Ļ��Һ��ʪ��Ȼ��ƽ����һ�鲬Ƭ�ϣ���ͨ��Դ����Ǧ������ֽ��д�֣�����ֺ�ɫ�ּ����ݴˣ�����������ȷ���ǣ� ��
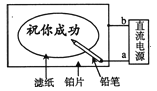
A. Ǧ��о��������������ԭ��Ӧ
B. ��Ƭ��������������������Ӧ
C. Ǧ�ʶ˸�������������������
D. ������H+�ŵ磬c��OH-���������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com