
【题目】白铁皮在发生析氢腐蚀时有0.2mol电子转移,下列说法正确的是( )
A. 有5.6 g金属被腐蚀
B. 有6.5 g金属被氧化
C. 有0.15 mol金属失去电子
D. 标准状况下有4.48 L H2逸出
科目:高中化学 来源: 题型:
【题目】“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶“威露士”牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO、1 000 mL、密度1.192 g·cm3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为________mol·L1。
(2)该同学取100 mL“威露士”牌“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)=________mol·L1。
(3)一瓶“威露士”牌“84消毒液”能吸收空气中________L的CO2(标准状况)而变质。(已知:CO2+2NaClO+H2O=Na2CO3+2HClO)
(4)该同学参阅“威露士”牌“84消毒液”的配方,欲用NaClO固体配制480 mL含25%NaClO的消毒液。下列说法正确的是________。

A.如图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,0.1mol·L-lCH3COOH的电离度(已电离的CH3COOH分子数/原CH3COOH分子总数)约为1%。该温度下,用0.1000mol·L-l氨水滴定10.00 mL0.1000mol·L-lCH3COOH溶液,溶液的pH与溶液的导电能力(I)的关系如图所示。下列说法正确的是

A. M点→N点,水的电离程度逐渐增大
B. 25℃时,CH3COOH 的电离常数约为1.0×10-2
C. N点溶液中,c(CH3COO-) =c(NH4+)=0.05 mol·L-l
D. 当滴入20 mL氨水时,溶液中c(CH3COO-)>c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用下图装置对电解氯化铜实验进行了研究。
装置 | 现象 |
| 电解一段时间时,阳极石墨表面产生气体,阴极石墨上附着红色物质,烧杯壁变热,溶液由蓝色变为绿色 |
(1)甲认为电解过程中阳极产生的_________是溶液变绿的原因。
(2)乙查阅资料,CuCl2溶液中存在平衡:Cu2+ + 4Cl-![]() [CuCl4]2-(黄色) ΔH>0。据此乙认为:电解过程中,[CuCl4]2-(黄色)浓度增大,与CuCl2蓝色溶液混合呈绿色。乙依据平衡移动原理推测在电解过程中[CuCl4]2-浓度增大的原因:________________。
[CuCl4]2-(黄色) ΔH>0。据此乙认为:电解过程中,[CuCl4]2-(黄色)浓度增大,与CuCl2蓝色溶液混合呈绿色。乙依据平衡移动原理推测在电解过程中[CuCl4]2-浓度增大的原因:________________。
(3)丙改用下图装置,在相同条件下电解CuCl2溶液,对溶液变色现象继续探究。
装置 | 现象 |
| 电解相同时间时,阳极石墨表面产生气泡,溶液仍为蓝色;阴极石墨上附着红色物质,溶液由蓝色变为绿色;U型管变热,冷却后阴极附近溶液仍为绿色 |
丙通过对现象分析证实了甲和乙的观点均不是溶液变绿的主要原因。丙否定甲的依据是________,否定乙的依据是________________。
(4)丙继续查阅资料:
i. 电解CuCl2溶液时可能产生[CuCl2]-,[CuCl2]-掺杂Cu2+后呈黄色
ii. 稀释含[CuCl2]-的溶液生成CuCl白色沉淀据此丙认为:电解过程中,产生[CuCl2]-掺杂Cu2+后呈黄色,与CuCl2蓝色溶液混合呈绿色。
丙进行如下实验:
a.取电解后绿色溶液2 mL,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
b. 另取少量氯化铜晶体和铜粉,向其中加2 mL浓盐酸,加热获得含[CuCl2]-的黄色溶液。
c. 冷却后向上述溶液……
d. 取c中2 mL溶液,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
① a的目的是__________________。
② 写出b中生成[CuCl2]-的离子方程式:____________________。
③ 补充c中必要的操作及现象:____________________。
丙据此得出结论:电解时阴极附近生成[CuCl2]-是导致溶液变绿的原因。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢溶液可作为采矿业废液消毒剂,如消除采矿废液中剧毒的氰化钾,反应方程式为KCN+H2O2+H2O=A+NH3↑(已配平),请回答:(提示:![]() 、
、![]() )
)
(1)生成物A的化学式是__________________________________________。
(2)该反应是否是氧化还原反应?________(填写“是”或“否”),其理由是_____________________。若是,则被还原的元素是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
有机物F是有机合成工业中一种重要的中间体。以甲苯和丙烯为起始原料合成F的工艺流程如下:

回答下列问题:
(1)化合物B中含氧官能团名称是_________F的结构简式__________________
(2)写出C与银氨溶液共热的化学反应方程式:_______________________
(3)化合物D不能发生的反应有__________________(填序号)。
①加成反应②取代反应③消去反应④氧化反应⑤水解反应
(4)B的含苯环结构的同分异构体还有__________种,其中一种的核磁共振氢谱中出现4个峰且不与FeCl3溶液发生显色反应的是____________(填结构简式)。
(5)B与D发生反应的类型________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。A为 ,B为 ,C为 ,D的最高价氧化物的水化物是 。 (用化学式填空)
Ⅱ.一定温度下,在1L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示: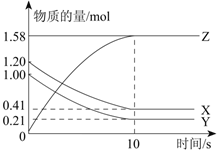
(1)反应开始到10 s,用Z表示的反应速率为 mol/(Ls)。
(2)反应开始到10 s,X的物质的量浓度减少了 mol/L。
(3)反应的化学方程式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验中需2mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3质量是
A.1000mL,212gB.950mL,543.4gC.950mL,572gD.500mL,286g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素[CO(NH2)2]是首个由无机物人工合成的有机物。
(1)工业上尿素由CO2和NH3在一定条件下合成,其反应方程式为_______________。
(2)当氨碳比 ![]() =4,时CO2的转化率随时间的变化关系如图1所示。
=4,时CO2的转化率随时间的变化关系如图1所示。
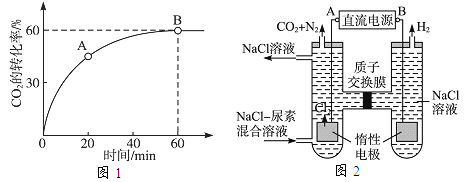
①A点的逆反应速率v逆(CO2)_______B点的正反应速率v正(CO2)(填“<”、“>”或“=”)。
②反应达到平衡后,NH3的转化率为_____________。
(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图2。
①电源的负极为_____(填“A”或“B”)。
②阳极室中发生的电极反应为_________,_________________。
③若两极共收集到气体13.44L(标准状况),则除去的尿素为________g(忽略气体的溶解)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com