
【题目】过氧化氢溶液可作为采矿业废液消毒剂,如消除采矿废液中剧毒的氰化钾,反应方程式为KCN+H2O2+H2O=A+NH3↑(已配平),请回答:(提示:![]() 、
、![]() )
)
(1)生成物A的化学式是__________________________________________。
(2)该反应是否是氧化还原反应?________(填写“是”或“否”),其理由是_____________________。若是,则被还原的元素是________。
科目:高中化学 来源: 题型:
【题目】如图为相互串联的甲乙两个电解池,请回答:
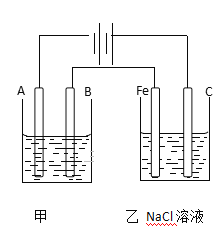
(1)甲池若为用电解精炼铜的装置,A是_________极,材料是__________,电极反应为_____________,B是___________极,材料是_______________,电极反应为_________,电解质溶液为________。
(2)若甲槽阴极增重12.8g,则乙槽阴极放出气体在标准状况下的体积为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于蛋白质的叙述,错误的是( )
A. 人体血浆中含有浆细胞分泌的蛋白质 B. DNA和蛋白质是染色体的组成成分
C. rRNA能参与蛋白质的生物合成 D. 核糖体上合成的蛋白质不能在细胞核发挥作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是25 ℃时某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为__________。
(2)pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是CH3COOK________NaClO,两溶液中:[c(Na+)-c(ClO-)]________[c(K+)-c(CH3COO-)](填“>”“<”或“=”)。
(3)向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=________。
(4)取10 mLpH=2的CH3COOH溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中![]() 的比值将________(填“增大”“减小”或“无法确定”)。
的比值将________(填“增大”“减小”或“无法确定”)。
(5)向碳酸钠溶液中滴加少量氯水的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白铁皮在发生析氢腐蚀时有0.2mol电子转移,下列说法正确的是( )
A. 有5.6 g金属被腐蚀
B. 有6.5 g金属被氧化
C. 有0.15 mol金属失去电子
D. 标准状况下有4.48 L H2逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水中的![]() 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中![]() 的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将
的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将![]() 还原为N2,其化学方程式为10Al+6NaNO3+4NaOH===10NaAlO2+3N2↑+2H2O。
还原为N2,其化学方程式为10Al+6NaNO3+4NaOH===10NaAlO2+3N2↑+2H2O。
请回答下列问题:
(1)上述反应中,________元素的化合价升高,则该元素的原子________(填“得到”或“失去”)电子;而________元素的化合价降低,则该元素的原子被________(填“氧化”或“还原”)。
(2)用“双线桥法”表示反应中电子转移的方向和数目:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列物质分类全部正确的是( )
①纯碱 ②食盐水 ③石灰水 ④NaOH ⑤液态氧 ⑥KClO3
A.碱--①④B.纯净物--③④C.盐--①⑥D.混合物--②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的(Na+和SO42-)可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是( )
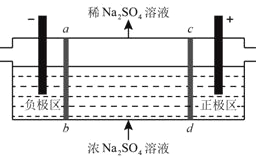
A. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
B. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液碱性增强
C. 阴极区溶液pH降低,阳极区溶液pH升高
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com