
| A、Na、Mg、Al |
| B、C、N、O |
| C、Cl、P、S |
| D、O、S、Se |


 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
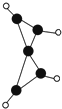 科学家最近在-100℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键).下列说法正确的是( )
科学家最近在-100℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键).下列说法正确的是( )| A、充分燃烧等质量的X和甲烷,X消耗氧气较多 |
| B、X是一种常温下能稳定存在的液态烃 |
| C、X和乙烷类似,都容易发生取代反应 |
| D、X既能使溴的四氯化碳溶液褪色又能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第一电离能:Na<Mg<Al |
| B、熔点:金刚石>晶体硅>碳化硅 |
| C、硬度:Li>Na>K |
| D、热稳定性:HF、HCl、HBr、HI依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 键 | H-H | N≡N | O=O | F-F | H-Cl |
| 键能 | 436 | 946 | 498 | 157 | 431 |
| 键 | N-N | P-P | P-O | Cl-Cl | Br-Br |
| 键能 | 193 | 198 | 360 | 242.7 | 193 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 2 |
| 1 |
| 2 |
| A、392.92KJ |
| B、2489.44KJ |
| C、784.92KJ |
| D、3274.3KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无氧酸是指分子组成中不含氧元素的酸,如HCl、CH4等 |
| B、根据溶解性的不同,可将碱分为难溶性碱和可溶性碱 |
| C、和酸反应生成盐和水的物质一定是碱性氧化物 |
| D、所有的酸性氧化物都可以与水化合得到相应的酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com