
【题目】抗癌药托瑞米芬的前体K的合成路线如图。
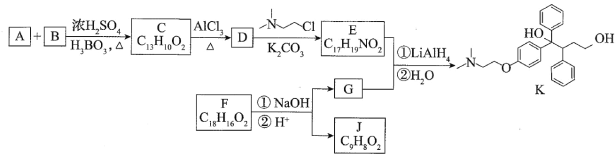
已知:
ⅰ.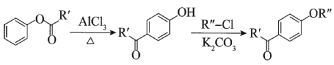 ;
;
ⅱ.有机物结构可用键线式表示,如(CH3)2NCH2CH3的键线式为![]() 。
。
(1)有机物A能与Na2CO3溶液反应产生CO2,其钠盐可用于食品防腐。有机物B能与Na2CO3溶液反应,但不产生CO2;B加氢可得环己醇。A和B反应生成C的化学方程式是_______。
(2)D中含有的官能团名称:_______。
(3)E的结构简式为_______。
(4)F是一种天然香料,经碱性水解、酸化,得G和J。J经还原可转化为G。J的结构简式为_______。
(5)M是J的同分异构体,符合下列条件的M的结构简式是_______。
①包含2个六元环
②M可水解,与NaOH溶液共热时,1molM最多消耗2molNaOH
(6)推测E和G反应得到K的过程中,反应物LiAlH4和H2O的作用是_______。
(7)由K合成托瑞米芬的过程:
![]()
托瑞米芬具有反式结构,其结构简式是_______。
【答案】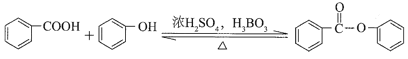 +H2O 羟基、羰基
+H2O 羟基、羰基 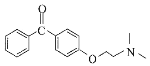
![]()
![]() 还原(加成)
还原(加成) 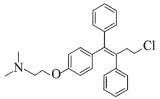
【解析】
有机物A能与Na2CO3溶液反应产生CO2,说明含有-COOH,且钠盐可用于食品防腐,结合K结构简式,A为![]() ,有机物B能与Na2CO3溶液反应,但不产生CO2,说明含有酚羟基,且B加氢可得环己醇,则B为
,有机物B能与Na2CO3溶液反应,但不产生CO2,说明含有酚羟基,且B加氢可得环己醇,则B为![]() ,根据ABC分子式知,AB发生酯化反应生成C为
,根据ABC分子式知,AB发生酯化反应生成C为![]() ,C发生信息i的反应生成D为
,C发生信息i的反应生成D为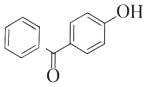 ,D生成E为
,D生成E为 ;F是一种天然香料,说明含有酯基,经碱性水解、酸化,得G和J,J经还原可转化为G,J不饱和度=
;F是一种天然香料,说明含有酯基,经碱性水解、酸化,得G和J,J经还原可转化为G,J不饱和度=![]() =6,根据K结构简式知,GJ中都含有苯环,苯环的不饱和度是4,根据O原子个数知,J中含有-COOH,所以还含有一个C=C,则J为
=6,根据K结构简式知,GJ中都含有苯环,苯环的不饱和度是4,根据O原子个数知,J中含有-COOH,所以还含有一个C=C,则J为![]() ,根据原子守恒知,G分子式为C9H10O,G的不饱和度为
,根据原子守恒知,G分子式为C9H10O,G的不饱和度为![]() =5,J经过还原可以得到G,所以G为
=5,J经过还原可以得到G,所以G为![]() ,EG发生加成反应生成K。
,EG发生加成反应生成K。
(1)通过以上分析知,A为![]() ,B为
,B为![]() ,C为
,C为![]() ,A和B反应生成C的化学方程式是
,A和B反应生成C的化学方程式是![]() +H2O,反应类型是取代反应或酯化反应。
+H2O,反应类型是取代反应或酯化反应。
故答案为: ![]() +H2O;
+H2O;
(2)D为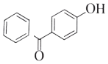 ,D中含有的官能团:羰基、羟基,
,D中含有的官能团:羰基、羟基,
故答案为:羰基、羟基;
(3)E的结构简式为 ,
,
故答案为: ;
;
(4)J的结构简式为![]() ,
,
故答案为:![]() ;
;
(5)J为![]() ,M是J的同分异构体,
,M是J的同分异构体,
①包含2个六元环;
②M可水解,说明含有酯基;与NaOH溶液共热时,1 mol M最多消耗 2 molNaOH,说明水解生成酚羟基和羧基,符合条件的结构简式为![]() ,
,
故答案为:![]() ;
;
(6)推测E和G反应得到K的过程中,该反应为加成反应,羰基上加上H原子,则反应物LiAlH4和H2O的作用是还原剂,
故答案为:还原剂;
(7)K发生消去反应生成N,N分子式为C26H29NO2,N和SOCl2发生取代反应生成托瑞米芬,根据反应前后分子式变化中Cl原子取代-OH,且托瑞米芬具有反式结构,则N为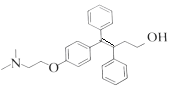 ,托瑞米芬为
,托瑞米芬为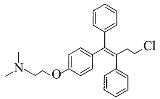 。
。
故答案为: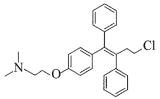 。
。


科目:高中化学 来源: 题型:
【题目】室温时10 mL某气态烃与过量的氧气混合,完全燃烧后的产物通过浓硫酸,再恢复至室温,气体体积减少了35mL ,剩余气体再通过氢氧化钠溶液,体积又减少了40 mL 。
(1)气态烃的分子式是__________。
(2)写出该气态烃所有同分异构体的结构简式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镓(Ga)应用广泛,在半导体和光电材料、合金、磁性材料等领域都有重要应用。镓与铝是同主族元素,性质相似。
(1)铝在元素周期表中的位置是__________________。
(2)GaAs 是一种重要的半导体材料。As 与 Ga 同周期,As 与 N 同主族。
①下列事实不能用元素周期律解释的是___________(填字母)。
a. 碱性:Ga (OH)3> Al (OH)3 b. 非金属性:As>Ga c. 酸性:H3AsO4>H3AsO3
②GaAs 中,As 元素化合价为-3 价,用原子结构理论解释原因_________________。
③废弃含 GaAs 半导体材料可以用浓硝酸溶解 GaAs,生成 H3AsO4 和 Ga3+,写出该反应的化学方程式_________。
(3)工业上获取镓的方法之一是从闪锌矿冶锌后的残渣(主要含有 Zn、Pb、Fe、Ga 等元素)中提取,某科研单位设计下述流程提取镓,已知:Ga 在碱性溶液中以[Ga(OH)4]- 形式存在。
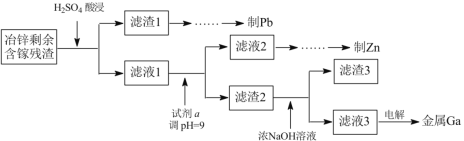
①试剂 a 是_______________。
②写出电解制镓时的阴极电极反应式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.(CH3)2C(Cl)CH2CH3的名称为:2-氯-2-甲基丁烷
B.可用新制氢氧化铜浊液鉴别乙醇、乙酸溶液
C.1mol有机物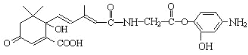 )与NaOH溶液反应,最多消耗5molNaOH
)与NaOH溶液反应,最多消耗5molNaOH
D.1molβ-紫罗兰酮(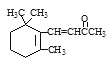 )与1molBr2发生加成反应可得到3种不同产物(不考虑立体异构)
)与1molBr2发生加成反应可得到3种不同产物(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.2mol/LKMnO4酸性溶液0.1L与一定量pH=3的草酸(HOOC—COOH)溶液混合,放出VL气体。NA表示阿伏加德罗常数的值,下列说法正确的是
A.该反应释放CO2分子数目为![]() NA
NA
B.pH=3的草酸溶液含有H+数目为0.001NA
C.0.1molHOOC—COOH含共用电子对数目为0.9NA
D.当1molKMnO4被还原时,转移电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含碳化合物在生产生活中广泛存在,Andren Dasic等提出在M+的作用下以N2O为氧化剂可以氧化乙烯生成乙醛,催化体系氧化还原循环如图所示,请回答下列问题。
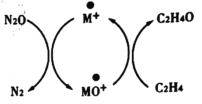
(1)已知N2O(g)+M+(s)=N2(g)+MO+(s) ΔH1=+678kJ·mol-1
MO+(s)+C2H4(g)=C2H4O(g)+M+(s) ΔH2=-283kJ·mol-1
请写出在M+的作用下以N2O为氧化剂氧化乙烯生成乙醛的热化学方程式:_________
(2)已知在含少量的I2溶液中,反应CH3CHO (aq)![]() CH4 (g) +CO (g)分两步进行:第Ⅰ步反应CH3CHO (aq) +I2 (aq) →CH3I (l) +HI (aq) +CO (g) (慢反应),第II步为快反应。
CH4 (g) +CO (g)分两步进行:第Ⅰ步反应CH3CHO (aq) +I2 (aq) →CH3I (l) +HI (aq) +CO (g) (慢反应),第II步为快反应。
①决定此反应快慢的是第______(填“Ⅰ”或“II”)步反应
②请写出第II步反应的化学方程式:_________
(3)若物质与氧原子的结合力用OA表示,氧原子与N2生成N2O的结合力OA(N2) =167.4 kJ·mol-1, 氧原子与乙烯生成乙醛的结合力OA (C2H4) = 473 kJ·mol-1,则可做该反应催化剂的M+与氧原子的的结合力OA (M+)的值应满足________,使用催化剂会使该反应的活化能________ (填“增大”、 “减小”、“不变”)。
(4)某2L容器中发生: 2CO2(g)![]() 2CO (g)+O2 (g),2molCO2在不同温度下平衡分解的情况如图所示。
2CO (g)+O2 (g),2molCO2在不同温度下平衡分解的情况如图所示。
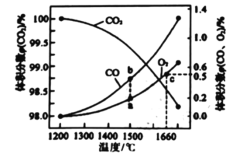
①恒温恒容条件下,能表示该可逆反应达到平衡状态的是______(填标号)
A.CO体积分数与O2体积分数的比值保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.容器内碳元素的质量分数保持不变
②图中a、b、c三点的平衡常数K(a)、K(b)、K(c)的大小关系为_______
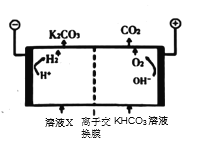
③为实现CO2减排,目前较成熟的方法是用高浓度的K2CO3溶液吸收工业烟气中的CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图,用必要的文字和化学用语简述![]() 在阴极区再生的原理____________。
在阴极区再生的原理____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是氧化镁和氯化镁的熔、沸点数据:
物质 | 氧化镁 | 氯化镁 |
熔点/℃ | 2852 | 714 |
沸点/℃ | 3600 | 1412 |
请参考以上数据分析,从海水中提取镁,正确的方法是( )
A.海水![]() Mg(OH)2
Mg(OH)2![]() Mg
Mg
B.海水![]() MgCl2溶液→MgCl2晶体
MgCl2溶液→MgCl2晶体![]() Mg
Mg
C.海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
D.海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液
MgCl2溶液![]() MgCl2(熔融)
MgCl2(熔融)![]() Mg
Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是( )
A.1L0.1molL-1H2C2O4溶液中含C2O![]() 离子数为0.1NA
离子数为0.1NA
B.2molNO与2molO2在密闭容器中充分反应,转移的电子数为8NA
C.32gS8与S6(![]() )的混合物中所含共价键数目为NA
)的混合物中所含共价键数目为NA
D.标准状况下22.4L氯气与甲烷的混合气体,光照时充分反应生成HCl分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧元素为地壳中含量最高的元素,可形成多种重要的单质和化合物。
(1)氧元素位于元素周期表中___________区;第二周期元素中,第一电离能比氧大的有___________种。
(2)O3可用于消毒。O3的中心原子的杂化形式为___________;其分子的 VSEPR模型为___________,与其互为等电子体的离子为___________(写出一种即可)。
(3)含氧有机物中,氧原子的成键方式不同会导致有机物性质不同。解释C2H5OH的沸点高于CH3OCH3的原因为___________;C2H5OH不能用无水CaCl2千燥是因为Ca2+和C2H5OH可形成[Ca(C2H5OH)4]2+,该离子的结构式可表示为______________________。
(4)氧元素可分别与Fe和Cu形成低价态氧化物FeO和Cu2O。

①FeO立方晶胞结构如图1所示,则Fe2+的配位数为___________;与O2-紧邻的所有Fe2+构成的几何构型为___________。
②Cu2O立方晶胞结构如图2所示,若O2-与Cu+之间最近距离为a pm,则该晶体的密度为___________g·cm-3。(用含a、NA的代数式表示,NA代表阿伏加德罗常数的值)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com