
【题目】氧元素为地壳中含量最高的元素,可形成多种重要的单质和化合物。
(1)氧元素位于元素周期表中___________区;第二周期元素中,第一电离能比氧大的有___________种。
(2)O3可用于消毒。O3的中心原子的杂化形式为___________;其分子的 VSEPR模型为___________,与其互为等电子体的离子为___________(写出一种即可)。
(3)含氧有机物中,氧原子的成键方式不同会导致有机物性质不同。解释C2H5OH的沸点高于CH3OCH3的原因为___________;C2H5OH不能用无水CaCl2千燥是因为Ca2+和C2H5OH可形成[Ca(C2H5OH)4]2+,该离子的结构式可表示为______________________。
(4)氧元素可分别与Fe和Cu形成低价态氧化物FeO和Cu2O。

①FeO立方晶胞结构如图1所示,则Fe2+的配位数为___________;与O2-紧邻的所有Fe2+构成的几何构型为___________。
②Cu2O立方晶胞结构如图2所示,若O2-与Cu+之间最近距离为a pm,则该晶体的密度为___________g·cm-3。(用含a、NA的代数式表示,NA代表阿伏加德罗常数的值)
【答案】p; 3 sp2杂化 平面三角形 NO2﹣ 乙醇分子间可形成氢键,沸点高 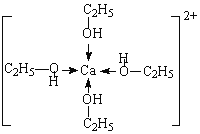 6 正八面体
6 正八面体 ![]()
【解析】
(1)除了ds区外,区的名称来自按构造原理最后填入电子的能级的符号;根据电离能的变化规律分析判断;
(2)根据公式计算出O3的中心原子的价层电子对数,再根据价层电子对互斥理论判断中心原子的杂化形式及其分子的VSEPR模型,与其互为等电子体的离子中含有3个原子、价电子数是18;
(3)形成分子间氢键的物质熔沸点较高;对于配离子[Ca(C2H5OH)4]2+可以结合常见配合物的结构与成键分析解答;
(4)①根据体心位置的Fe2+判断Fe2+的配位数;根据结构示意图判断与O2-紧邻的所有Fe2+构成的几何构型;
②若O2-与Cu+之间最近距离为apm,该距离为晶胞体对角线的![]() ,则晶胞体对角线长度=4apm,计算出晶胞的棱长,根据化学式判断出各球表示的微粒,再结合密度的计算公式计算。
,则晶胞体对角线长度=4apm,计算出晶胞的棱长,根据化学式判断出各球表示的微粒,再结合密度的计算公式计算。
(1)除了ds区外,区的名称来自按构造原理最后填入电子的能级的符号,O原子最后通入的电子是p电子,所以O元素位于p区;第二周期元素中,第一电离能比O元素大的有N、F、Ne元素,所以有3种元素,故答案为:p;3;
(2)O3的中心原子的价层电子对个数=2+![]() =3且含有1个孤电子对,根据价层电子对互斥理论判断中心原子的杂化形式为sp2杂化、其分子的 VSEPR模型为平面三角形,与其互为等电子体的离子中含有3个原子、价电子数是18,与其互为等电子体的阴离子有NO2﹣(合理即可),故答案为:sp2杂化;平面三角形;NO2﹣(合理即可);
=3且含有1个孤电子对,根据价层电子对互斥理论判断中心原子的杂化形式为sp2杂化、其分子的 VSEPR模型为平面三角形,与其互为等电子体的离子中含有3个原子、价电子数是18,与其互为等电子体的阴离子有NO2﹣(合理即可),故答案为:sp2杂化;平面三角形;NO2﹣(合理即可);
(3)形成分子间氢键的物质熔沸点较高,乙醇能形成分子间氢键、甲醚不能形成分子间氢键,所以乙醇的熔沸点比甲醚高;C2H5OH不能用无水CaCl2干燥是因为Ca2+和C2H5OH可形成[Ca(C2H5OH)4]2+,该离子中钙离子为中心离子,乙醇为配体,乙醇中O原子提供孤电子对、钙离子提供空轨道形成配位键,其结构为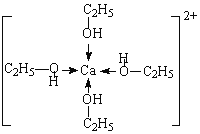 ,故答案为:乙醇分子间可形成氢键,沸点高;
,故答案为:乙醇分子间可形成氢键,沸点高; ;
;
(4)①Fe2+的配位数为6;与O2﹣紧邻的所有Fe2+构成的几何构型、与Fe2+紧邻的所有O2﹣构成的几何构型相同,根据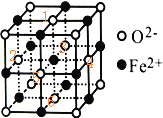 知,表中有标记的这几个离子形成正八面体,同理可推,与O2﹣紧邻的所有Fe2+构成的几何构型为正八面体,故答案为:6;正八面体;
知,表中有标记的这几个离子形成正八面体,同理可推,与O2﹣紧邻的所有Fe2+构成的几何构型为正八面体,故答案为:6;正八面体;
②若O2﹣与Cu+之间最近距离为apm,该距离为晶胞体对角线的![]() ,则晶胞体对角线长度=4apm,晶胞棱长=
,则晶胞体对角线长度=4apm,晶胞棱长=![]() =
=![]() ×10﹣10 cm,晶胞体积=(
×10﹣10 cm,晶胞体积=(![]() ×10﹣10 cm)3,该晶胞中白球离子个数=1+8×
×10﹣10 cm)3,该晶胞中白球离子个数=1+8×![]() =2、灰球离子个数为4,根据化学式Cu2O知,灰色球表示亚铜离子、白色球表示氧离子,则该晶体的密度=
=2、灰球离子个数为4,根据化学式Cu2O知,灰色球表示亚铜离子、白色球表示氧离子,则该晶体的密度=![]() =
=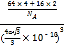 g/cm3=
g/cm3=![]() g/cm3,故答案为:
g/cm3,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】工业上采用酸性高浓度含砷废水(砷主要以亚砷酸H3AsO3形式存在)提取中药药剂As2O3.工艺流程如下:
 回答下列问题:
回答下列问题:
(1)“沉砷”中所用Na2S的电子式为_____________。
(2)已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS33- ;“沉砷”中FeSO4的作用是_____。
2AsS33- ;“沉砷”中FeSO4的作用是_____。
(3)“焙烧”过程中由于条件的原因,生成的三氧化二铁中混有四氧化三铁,证明四氧化三铁存在的试剂是___________。(写名称)
(4)“氧化”过程中,可以用单质碘为氧化剂进行氧化,写出该反应的离子方程式__________。
(5)调节pH=0时,请写出由Na3AsO4制备As2O3的离子方程式_________________。
(6)一定条件下,用雄黄(As4S4)制备As2O3的转化关系如图所示。若反应中,1molAs4S4(其中As元素的化合价为+2价)参加反应时,转移28mole-,则物质a为___________。(填化学式)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型镁-锂双离子二次电池如图,下列关于该电池的说法不正确的是

A. 放电时,Li+由左向右移动
B. 放电时,正极的电极反应式为Li1-xFePO4+xLi++xe-= LiFePO4
C. 充电时,外加电源的正极与Y相连
D. 充电时,导线上每通过1mol e-,左室溶液质量减轻12g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.分子晶体中一定存在分子间作用力,不一定存在共价键
B.因为水分子间存在氢键,所以水分子的稳定性很好
C.离子晶体一定含有金属阳离子
D.元素的非金属性越强,其单质的活泼性一定越强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶“威露士”牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO、1000mL、密度1.192g·cm3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为_____mol·L1。
(2)该同学取100 mL“威露士”牌“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)=____mol·L1。
(3)一瓶“威露士”牌“84消毒液”能吸收空气中____L的CO2(标准状况)而变质。(已知:CO2+2NaClO+H2O=Na2CO3+2HClO)
(4)该同学参阅“威露士”牌“84消毒液”的配方,欲用NaClO固体配制480mL含25%NaClO的消毒液。下列说法正确的是____。

A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用氯气与一氧化氮在常温常压条件下合成亚硝酰氯(NOCl)。已知亚硝酰氯是一种黄色气体,熔点:-64.5℃,沸点:-5.5℃,遇水易反应生成一种无氧酸和两种氮的常见氧化物
(1)甲组同学拟制备原料气NO和Cl2制备装置如图所示

①为制备并得到纯净干燥的气体,补充下表中缺少的药品。
装置I中药品 | 装置II中药品 | ||
蒸馏烧瓶 | a仪器 | ||
制备纯净Cl2 | KmnO4 | 浓盐酸 | (i)___________ |
制备纯净的NO | Cu | (ii)__________ | 水 |
②仪器a的名称为____;装置Ⅲ的作用是______________。
(2)乙组同学对甲组同学制取NO的装置略加改良,利用甲组制得的Cl2共同制备NOCl,装置如下图所示

①组装好实验装置,检查气密性,依次装入药品。此实验关健操作有两点:I将Cl2充满D装置的三颈瓶;Ⅱ,A中反应开始时,先关闭K2,打开K1,待NO充满装置后关闭K1,打开K2。这两步操作都要“充满”,目的是__________。
②装置B中水的作用是___________________(用化学方程式表示)。
③若装置C中压强过大,可以观察到的现象是________________。
④装置D中冰盐水的作用是___________________________。
⑤如果去掉盛有浓硫酸的C、装有无水CaCl2的E两装置,对该实验的主要影响是________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质反应(表内物质均为反应物),反应刚开始时,放出H2的速率最大的是
编号 | 金属(粉末状) | 酸的浓度 | 酸的体积 | 反应起始温度 |
A | 0.1mol Zn | 6mol/L HNO3 | 10mL | 50℃ |
B | 0.1mol Fe | 3mol/L H2SO4 | 20mL | 30℃ |
C | 0.1mol Zn | 3mol/L H2SO4 | 10mL | 30℃ |
D | 0.1mol Zn | 3mol/L HCl | 40mL | 30℃ |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 可食用植物油含有的高级脂肪酸甘油酯是人体的营养物质
B. 石油的分馏、煤的液化和气化都是物理变化,石油的裂化、裂解都是化学变化
C. 淀粉、蛋白质、葡萄糖都是高分子化合物
D. 以重油为原料裂解得到各种轻质油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下进行甲、乙、丙三组实验,三组实验均各取相同物质的量的盐酸,加入同一种镁铝合金粉末,产生气体,有关数据见表:
实验序号 | 甲 | 乙 | 丙 |
合金质量/mg | 255 | 385 | 459 |
生成气体/mL | 280 | 336 | 336 |
请回答下列问题:
(1)要算出盐酸的物质的量,题中作为计算依据的数据是___,求得的盐酸的溶质物质的量为___;
(2)求合金中Mg、Al的物质的量之比,题中可作为计算依据的数据是___,求得请务必写出计算过 程:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com