
【题目】元素周期表中的四种元素的有关信息如下,请用合理的化学用语填写空白。
在周期表中的区域 | 元素代号 | 有关信息 |
短周期元素 | X | X的最高价氧化物的水化物甲是一种胃酸中和剂,且能溶于强碱溶液 |
Y | Y的一种氢化物可用于制造纯碱和做制冷剂 | |
长周期元素 | Z | Z的一种盐乙可以做净水剂, |
W | W元素大量存在于海藻中,它的银盐可用于人工降雨 |
(1)X元素周期表中的位置为_____,X、Y、W三种元素的简单离子半径从大到小的顺序为_______。
(2)足量W的最高价氧化物的水化物的稀溶液与1mol甲完全反应,放出热量QkJ,请写出表示该过程中和热的热化学方程式_____。
(3)下列有关W的气态氢化物丁的说法正确的有_______(选填字母)
a、丁比氯化氢沸点高 b、丁比氯化氢稳定性好
c、丁比氟化氢还原性弱 d、丁比氟化氢酸性弱
(4)请写出丙溶于丁的水溶液的离子方程式____________。
【答案】第三周期ⅢA族 r(I—)>r(N3—)>r(Al3+) HIO4(aq)+![]() Al(OH)3(s)=H2O(l)+
Al(OH)3(s)=H2O(l)+![]() Al(IO4)3(aq)△H=-
Al(IO4)3(aq)△H=-![]() QkJ/mol a Fe2O3+6H++2I—=2Fe2++I2+3H2O
QkJ/mol a Fe2O3+6H++2I—=2Fe2++I2+3H2O
【解析】
X的最高价氧化物的水化物甲是一种胃酸中和剂,且能溶于强碱溶液,则甲为氢氧化铝,X为Al元素;Y的一种氢化物可用于制造纯碱和做制冷剂,则该氢化物为氨气,Y为N元素;Z的一种盐乙可以做净水剂,![]() 的某种氧化物丙可以做红色涂料,则丙为氧化铁,乙为铁盐,Z为Fe元素;W元素大量存在于海藻中,它的银盐可用于人工降雨,则W为I元素,在结合元素周期律与物质的性质分析答题。
的某种氧化物丙可以做红色涂料,则丙为氧化铁,乙为铁盐,Z为Fe元素;W元素大量存在于海藻中,它的银盐可用于人工降雨,则W为I元素,在结合元素周期律与物质的性质分析答题。
根据上述分析可知:X为Al元素,Y为N元素,Z为Fe元素,W为I元素,
(1)X为Al元素,原子序数为13,在周期表中的位置为第三周期第ⅢA族;原子的电子层数越大,其原子半径越大,电子层数相同时,其离子半径随着原子序数的增大而减小,则X、Y、W三种元素的简单离子半径从大到小的顺序为:r(I—)>r(N3—)>r(Al3+),故答案为:r(I—)>r(N3—)>r(Al3+)。
(2)W的最高价氧化物的水化物为HIO4与1mol氢氧化铝完全反应,放出热量QkJ,则反应生成1mol水所放出的热量为![]() QkJ,则表示该过程中和热的热化学方程式为:HIO4(aq)+
QkJ,则表示该过程中和热的热化学方程式为:HIO4(aq)+![]() Al(OH)3(s)=H2O(l)+
Al(OH)3(s)=H2O(l)+![]() Al(IO4)3(aq) △H=-
Al(IO4)3(aq) △H=-![]() QkJ/mol,故答案为:HIO4(aq)+
QkJ/mol,故答案为:HIO4(aq)+![]() Al(OH)3(s)=H2O(l)+
Al(OH)3(s)=H2O(l)+![]() Al(IO4)3(aq) △H=-
Al(IO4)3(aq) △H=-![]() QkJ/mol。
QkJ/mol。
(3)W的气态氢化物丁为HI,则
a.HCl与HI均为共价化合物,其分子间作用力越大,沸点越高,则分子间作用力大小:HI>HCl,则沸点高低:HI>HCl,故a正确;
b.非金属性越强,对应气态氢化物的稳定性越高,则碘化氢比氯化氢稳定性低,故b错误;
c.同主族元素中非金属性从上而下依次减弱,单质的氧化性依次减弱,则相应离子的还原性依次增强,则碘化氢比氟化氢还原性强,故c错误;
d.氟化氢为弱酸,碘化氢为强酸,则碘化氢比氟化氢酸性强,故d错误。
故答案为:a。
(4)丙为氧化铁,丁为HI,两者会发生氧化还原反应,其离子方程式为:Fe2O3+6H++2I—=2Fe2++I2+3H2O,故答案为:


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
【题目】【有机选做】有机物DBP常用作纤维素树脂和聚氯乙烯的增塑剂,特别适用于硝酸纤维素涂料。具有优良的溶解性、分散性和粘着性。由有机物A和邻二甲苯为原料可以合成DBP。
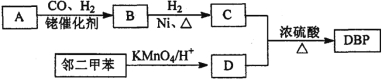
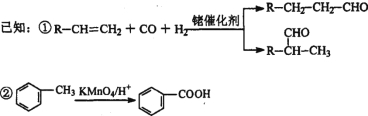
③烃A是有机合成的重要原料。A的质谱图最大m/z为42,红外光谱表明分子中含有碳碳双键;B能发生银镜反应;有机物C的核磁共振氢谱显示其分子中含有5种化学环境不同的氢原子,且个数之比为3:2:2:2:l。
回答下列问题:
(1)A的结构简式为________;A在一定条件下生成聚合物的化学方程式为_______________。
(2)D中的含氧官能团是___________。有机物D和足量有机物C反应生成DBP的化学方程式是____________________________________________。
(3)下列说法正确的是___________ (选填序号字母)。
A.A能发生聚合反应、加成反应和氧化反应
B.与C互为同分异构体,且含有相同官能团的有机物有2种
C.邻二甲苯能氧化生成D说明有机物分子中基团之间存在影响
D.1 mol DBP可与含4mol NaOH的溶液完全反应
(4)工业上常用有机物E(C8H4O3)代替D生产DBP。反应分为两步进行:
i)E+C![]() 中间产物 ii)中间产物+C
中间产物 ii)中间产物+C ![]() DBP+H2O
DBP+H2O
①请猜测E的结构简式___________。[
②工业上生产有机物E的反应如下:2X+9O2![]() 2E+4CO2+4H2O,芳香烃X的一溴代物只有两种。X的结构简式是________。
2E+4CO2+4H2O,芳香烃X的一溴代物只有两种。X的结构简式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环扁桃酯具有松弛血管平滑肌、扩张血管的功能,其结构简式如下图。下列对该物质的叙述中,正确的是
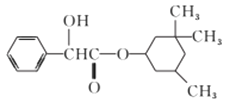
A. 该有机物苯环上的二氯代物共有8种
B. 该有机物分子中至少有7个碳原子共平面
C. 该有机物可以与Br2的CCl4溶液发生加成反应使之褪色
D. 1mol该有机物最多可与2molNaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中a、b分别是原电池的两极,接通电路后发现a极板质量增加,b极板溶解,符合这一情况的是( )
a极板 | b极板 | a电极 | Z溶液 | |
A | 锌 | 石墨 | 负极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 银 | 铁 | 正极 | AgNO3 |
D | 铜 | 石墨 | 正极 | CuCl2 |
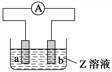
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿托酸甲酯是一种治疗肠道疾病的药物,是由阿托酸(![]() )和甲醇反应制得,完成下列填空:
)和甲醇反应制得,完成下列填空:
(1)写出阿托酸甲酯的结构简式:________。
(2)A是比![]() 多两个碳原子且苯环上只有一个取代基的一种同系物,且A的所有碳原子可以处于同一平面上,写出A的结构简式____________。
多两个碳原子且苯环上只有一个取代基的一种同系物,且A的所有碳原子可以处于同一平面上,写出A的结构简式____________。
(3)![]() 是阿托酸甲酯的某种同分异构体的一氯代物,其与足量氢氧化钠溶液共热,生成的有机产物的结构简式为_____________、_______________。
是阿托酸甲酯的某种同分异构体的一氯代物,其与足量氢氧化钠溶液共热,生成的有机产物的结构简式为_____________、_______________。
(4)工业上由![]() 经过四步不同类型的反应制得阿托酸。
经过四步不同类型的反应制得阿托酸。
①请按实际进行的反应顺序写出指定反应步骤中所需要的试剂和反应条件:
第一步_________________;第二步________________。
②写出第四步反应的化学方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】EPR橡胶( )广泛应用于汽车部件、建筑用防水材料、电线电缆护套、耐热胶管、汽车密封件、润滑油添加剂及其它制品。
)广泛应用于汽车部件、建筑用防水材料、电线电缆护套、耐热胶管、汽车密封件、润滑油添加剂及其它制品。
PC塑料(  )的透光性良好,可制作车、船、飞机的挡风玻璃以及眼镜等。它们的合成路线如下:
)的透光性良好,可制作车、船、飞机的挡风玻璃以及眼镜等。它们的合成路线如下:
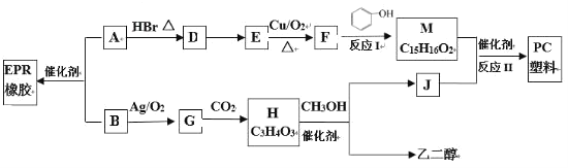
已知:①RCOOR1+R2OH→ RCOOR2 +R1OH
②B、F、G、H、J各物质中,核磁共振氢谱都只有一组吸收峰。
(1)B的结构简式:____________。
(2)A→D的反应类型:____________。
(3)E中官能团名称:____________。
(4)E→F的化学方程式:____________。
(5)H的结构简式:____________。
(6)反应II的化学方程式:____________。
(7)下列说法正确的是:____________。
a.反应I的原子利用率为100%
b.1mol J与足量的NaOH溶液反应,消耗2molNaOH
c.CH3OH在合成PC塑料过程中可以循环利用
(8)反应I过程中,可以得到两种同类型副产物,且与M互为同分异构体,请写出其中一种结构:_________。
(9)![]() ,试推断N的结构:____________。
,试推断N的结构:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究氯、溴、硫的非金属性强弱,设计如下实验装置(加热及夹持装置已略)。
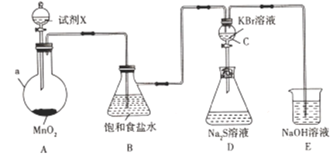
(1)仪器a的名称是______。试剂X是_____________。
(2)写出装置A中发生反应的化学方程式:__________________________________
(3)装置E中NaOH溶液的作用是____________________________________________
(4)反应一段时间后,观察到装置C中溶液变为橙黄色,说明非金属性:Cl___Br( 填“>"或"<")。
(5)打开装置C中的活塞,将装置C中的溶液逐渐滴人装置D中,振荡。观察到的现象是______________,写出可能发生反应的离子方程式:_____________________________________写一个即可),根据此现象不一定能说明溴的非金属性比硫强,原因是___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在短周期元素中:
①元素周期表IA族中金属性最强的元素(符号)是____,与水反应最剧烈的VIIA族中的非金属元素的(符号)是___;
②原子核外电子总数是其最外层电子数2倍的元素名称是__,最外层电子数为电子层2倍的元素名称有____。
(2)已知某主族元素的原子结构示意图如图,Y在周期表的位置为___。

(3)A2-原子核内有x个中子,其质量数为m,则ngA2-所含电子的物质的量为__。
(4)X、Y、Z均为短周期元素,它们在周期表中的相对位置如图所示。
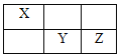
已知X、Y、Z三元素的原子序数之和为40,回答下列问题:
①Z元素的原子结构示意图为___。
②与Y同主族的下一周期元素的原子序数是___。
③X的气态氢化物与Y的最高价氧化物对应水化物发生的化学反应方程式___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com