
【题目】为了探究氯、溴、硫的非金属性强弱,设计如下实验装置(加热及夹持装置已略)。
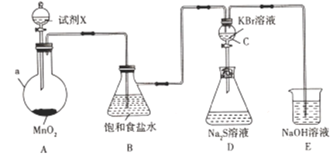
(1)仪器a的名称是______。试剂X是_____________。
(2)写出装置A中发生反应的化学方程式:__________________________________
(3)装置E中NaOH溶液的作用是____________________________________________
(4)反应一段时间后,观察到装置C中溶液变为橙黄色,说明非金属性:Cl___Br( 填“>"或"<")。
(5)打开装置C中的活塞,将装置C中的溶液逐渐滴人装置D中,振荡。观察到的现象是______________,写出可能发生反应的离子方程式:_____________________________________写一个即可),根据此现象不一定能说明溴的非金属性比硫强,原因是___________________________________________。
【答案】圆底烧瓶 浓盐酸 MnO2 +4HCl(浓)![]() MnCl2 +Cl2↑+2H2O 吸收多余氯气,防止污染环境 > 溶液变浑浊 Br2 +S2-=2Br- +S↓(或Cl2+S2-=2C1- +S↓) 溴水中可能含有氯气,干扰实验
MnCl2 +Cl2↑+2H2O 吸收多余氯气,防止污染环境 > 溶液变浑浊 Br2 +S2-=2Br- +S↓(或Cl2+S2-=2C1- +S↓) 溴水中可能含有氯气,干扰实验
【解析】
为了探究氯、溴、硫的非金属性强弱,装置A用于制备Cl2,装置C是验证Cl2的氧化性强于Br2 的氧化性,C装置生成的Br2 氧化D装置中的S2-,证明Br2 的氧化性强于S的。E装置是尾气吸收处理,防止污染环境。
(1)装置A用于制备Cl2,仪器a是圆底烧瓶,试剂X是浓盐酸;
(2)装置A中浓盐酸与二氧化锰反应制取氯气,反应的化学方程式为MnO2 +4HCl(浓)![]() MnCl2 +Cl2↑+2H2O ;
MnCl2 +Cl2↑+2H2O ;
(3)氯气是有毒气体,装置E是尾气处理装置,故装置E中NaOH溶液的作用是吸收多余氯气,防止污染环境;
(4)反应一段时间后,观察到装置C中溶液变为橙黄色,是因为Cl2把装置C中的Br-氧化成Br2,反应的离子方程式为Cl2+2Br-=Br2+2Cl-,说明非金属性:Cl>Br;
(5)打开装置C中的活塞,将装置C中的溶液逐渐滴人装置D中,振荡。装置C中生成的Br2或者装置C中溶解了未反应完全的Cl2氧化装置D中的S2-,生成淡黄色的硫单质,可能发生反应的离子方程式为Br2 +S2-=2Br- +S↓(或Cl2+S2-=2C1- +S↓)。


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】工业制硫酸中的一步重要反应是SO2在400-500℃和常压下的催化氧化: 2SO2 + O2![]() 2SO3, 这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述相关说法中错误的是
2SO3, 这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述相关说法中错误的是
A.反应温度选择400-500℃是该反应催化剂的催化活性、反应速率、反应限度等角度综合考虑的结果
B.因为在常压下该反应的速率和SO2的转化率已经很高了,所以选择常压条件主要是从生产成本角度考虑
C.为提高SO2的转化率,应适当提高O2的浓度
D.使用催化剂是为了加快反应速率,提高SO3产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中的四种元素的有关信息如下,请用合理的化学用语填写空白。
在周期表中的区域 | 元素代号 | 有关信息 |
短周期元素 | X | X的最高价氧化物的水化物甲是一种胃酸中和剂,且能溶于强碱溶液 |
Y | Y的一种氢化物可用于制造纯碱和做制冷剂 | |
长周期元素 | Z | Z的一种盐乙可以做净水剂, |
W | W元素大量存在于海藻中,它的银盐可用于人工降雨 |
(1)X元素周期表中的位置为_____,X、Y、W三种元素的简单离子半径从大到小的顺序为_______。
(2)足量W的最高价氧化物的水化物的稀溶液与1mol甲完全反应,放出热量QkJ,请写出表示该过程中和热的热化学方程式_____。
(3)下列有关W的气态氢化物丁的说法正确的有_______(选填字母)
a、丁比氯化氢沸点高 b、丁比氯化氢稳定性好
c、丁比氟化氢还原性弱 d、丁比氟化氢酸性弱
(4)请写出丙溶于丁的水溶液的离子方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素,原子半径的大小关系为r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质在适当的条件下可发生如图所示的变化,其中A为X、Y组成的双原子分子,B和C均为10电子分子。下列说法不正确的是
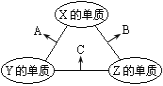
A.X元素位于第ⅥA族B.A不能溶于B中
C.A和C不可能发生氧化还原反应D.C溶于B形成的溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是打开物质世界奧秘之门的一把金钥匙 ,1869年,门捷列夫发现了元素周期律并发表了元素周期表。下图为元素周期表的一部分,回答下列问题。
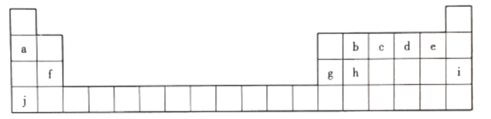
(1).上述元素中化学性质最稳定的是________(填元素符号,下同) ,非金属性最强的是_____。
(2)c的最高价氧化物对应水化物的化学式为__________。
(3)h元素的原子结构示意图为__________,写出h单质的一种用途:__________。
(4)b、d、f三种元素原子半径由大到小的顺序是__________(用元素符号表示)。
(5)a、g、j的氢氧化物中碱性最强的是__________(填化学式),写出其溶液与g的氧化物反应的离子方程式:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,下列有关反应的叙述错误的是( )
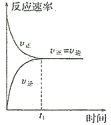
A.开始反应时,正反应速率最大,逆反应速率为零
B.随着反应的进行,正反应速率逐渐减小,逆反应速率逐渐增大
C.反应到达![]() 时,正反应速率与逆反应速率相等,反应停止
时,正反应速率与逆反应速率相等,反应停止
D.反应在![]() 之后,正反应速率与逆反应速率相等,反应达到化学平衡状态
之后,正反应速率与逆反应速率相等,反应达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以2-甲基丙烯为原料,合成有机玻璃F的合成路线如下:
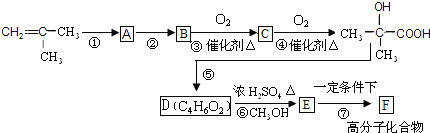
(1)填写反应类型:反应⑦是____________________,反应⑤是____________。
(2)写出结构简式:B_________________ F__________________。
(3)写出物质D中所含官能团的名称:___________________________。
(4)写出反应③的化学方程式_____________________________________。
(5)已知:化合物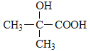 同类别的同分异构体G,在一定条件下能形成八元环状化合物。则G可能的结构简式为:_____________________________________________________。
同类别的同分异构体G,在一定条件下能形成八元环状化合物。则G可能的结构简式为:_____________________________________________________。
(6)完成反应:_________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对如图所示的两种化合物的结构或性质描述正确的是:
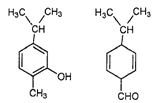
A. 均能与溴水反应B. 分子中肯定共平面的碳原子数相同
C. 不是同分异构体D. 可以用红外光谱区分,亦能用核磁共振氢谱区分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电池接通后,向乙中滴入酚酞溶液,在F极附近溶液显红色。则以下说法正确的是

A.电源B极是正极
B.甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1∶2∶2∶1
C.欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D.装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com