
����Ŀ��Ԫ�����ڱ��Ǵ���������W��֮�ŵ�һ�ѽ�Կ�� ��1869�꣬�Ž��з�����Ԫ�������ɲ�������Ԫ�����ڱ�����ͼΪԪ�����ڱ���һ���֣��ش��������⡣
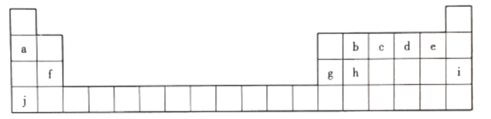
(1).����Ԫ���л�ѧ�������ȶ�����________(��Ԫ�ط��ţ���ͬ) ���ǽ�������ǿ����_____��
(2)c������������Ӧˮ����Ļ�ѧʽΪ__________��
(3)hԪ�ص�ԭ�ӽṹʾ��ͼΪ__________��д��h���ʵ�һ����;:__________��
(4)b��d��f����Ԫ��ԭ�Ӱ뾶�ɴ�С��˳����__________(��Ԫ�ط��ű�ʾ)��
(5)a��g��j�����������м�����ǿ����__________(�ѧʽ)��д������Һ��g�������ﷴӦ�����ӷ���ʽ:___________________________________��
���𰸡�Ar F HNO3 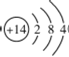 �ƹ��� Mg>C>O KOH Al2O3 +2OH-=2AlO2- +H2O
�ƹ��� Mg>C>O KOH Al2O3 +2OH-=2AlO2- +H2O
��������
��Ԫ�����ڱ���֪��aΪLi��bΪC��cΪN��dΪO��eΪF��fΪMg��gΪAl��hΪSi��iΪAr��jΪK��
��1��0��Ԫ�صĻ�ѧ�������ȶ���������Ԫ���л�ѧ�������ȶ�����Ar��FԪ�صķǽ�������ǿ��
��2��cΪN��������������Ӧ��ˮ����ΪHNO3��
��3��hΪSi���˵����Ϊ14��ԭ�ӵĺ��������Ҳ��14��Si��ԭ�ӽṹʾ��ͼΪ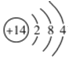 ��Si���ʵ�һ����;�ǿ����ƹ��أ�
��Si���ʵ�һ����;�ǿ����ƹ��أ�
��4��bΪC��dΪO��fΪMg�������Ӳ�����ͬʱ���˵����Խ��ԭ�Ӱ뾶ԽС�����Ӳ���Խ��ԭ�Ӱ뾶Խ��b��d��f����Ԫ��ԭ�Ӱ뾶�ɴ�С��˳����Mg>C>O��
��5��aΪLi��gΪAl��jΪK��K�Ľ�������ǿ��������Խǿ������������Ӧ��ˮ����ļ���Խǿ����a��g��j�����������м�����ǿ����KOH��g��������ΪAl2O3��Al2O3��KOH��Һ��Ӧ�����ӷ���ʽΪAl2O3 +2OH-=2AlO2- +H2O ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȼ�ϵ����һ�־���Ӧ��ǰ������ɫ��Դ����ͼΪȼ�ϵ�صĽṹʾ��ͼ���������ҺΪNaOH��Һ���缫����Ϊ���ɶ��ʯī������ش���������:
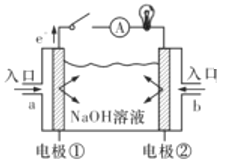
(1)����ȼ�ϵ��Ϊ����ȼ�ϵ�ء�
��a��ͨ�������Ϊ_____(����������)���������Һ�е�OH������______��(�����������)��
��д��������ȼ�ϵ�ع���ʱ�������ĵ缫��Ӧʽ��______________��
(2)����ȼ�ϵ��Ϊ����ȼ�ϵ�ء���֪��ص��ܷ�ӦΪCH4+2O2+2OH-=CO32-+3H2O
�������й�˵����ȷ����___________(����ĸ����)��
A.ȼ�ϵ�ؽ�����ת��Ϊ��ѧ��
B.�����ĵ缫��ӦʽΪCH4+10OH--8e-=CO32-+7H2O
C.�����ĵ缫��ӦʽΪO2+4H++4e-=2H2O
D.ͨ�����ĵ缫������ԭ��Ӧ
�ڵ����ļ���33.6L(��״����)ʱ�������ص�����ת��Ч��Ϊ80����������ת�Ƶĵ��ӵ����ʵ���Ϊ______mol.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������һ�����Ƴ���������ҩ����ɰ�����(![]() )�ͼ״���Ӧ�Ƶã����������գ�
)�ͼ״���Ӧ�Ƶã����������գ�
��1��д������������Ľṹ��ʽ��________��
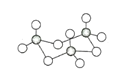
��2��A�DZ�![]() ������̼ԭ���ұ�����ֻ��һ��ȡ������һ��ͬϵ���A������̼ԭ�ӿ��Դ���ͬһƽ���ϣ�д��A�Ľṹ��ʽ____________��
������̼ԭ���ұ�����ֻ��һ��ȡ������һ��ͬϵ���A������̼ԭ�ӿ��Դ���ͬһƽ���ϣ�д��A�Ľṹ��ʽ____________��
��3��![]() �ǰ����������ij��ͬ���칹���һ�ȴ��������������������Һ���ȣ����ɵ��л�����Ľṹ��ʽΪ_____________��_______________��
�ǰ����������ij��ͬ���칹���һ�ȴ��������������������Һ���ȣ����ɵ��л�����Ľṹ��ʽΪ_____________��_______________��
��4����ҵ����![]() �����IJ���ͬ���͵ķ�Ӧ�Ƶð����ᡣ
�����IJ���ͬ���͵ķ�Ӧ�Ƶð����ᡣ
���밴ʵ�ʽ��еķ�Ӧ˳��д��ָ����Ӧ����������Ҫ���Լ��ͷ�Ӧ������
��һ��_________________���ڶ���________________��
��д�����IJ���Ӧ�Ļ�ѧ����ʽ��________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��þ-��������ȼ�ϵ�ص�ԭ��ΪMg + H2O2 + H2SO4=MgSO4+ 2H2O ����װ����ͼ��ʾ������˵���������
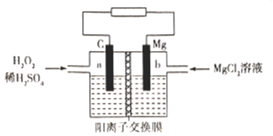
A.a��������ԭ��ӦB.������b�����������Һ����a��
C.Mg2+���Ҳྭ�������ӽ���Ĥ�������D.b���缫��ӦʽΪMg-2e-=Mg2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��̽���ȡ��塢��ķǽ�����ǿ�����������ʵ��װ��(���ȼ��г�װ������)��
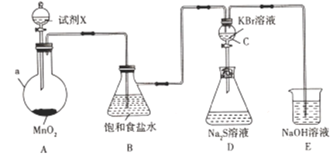
(1)����a��������______���Լ�X��_____________��
(2)д��װ��A�з�����Ӧ�Ļ�ѧ����ʽ:__________________________________
(3)װ��E��NaOH��Һ��������____________________________________________
(4)��Ӧһ��ʱ��۲쵽װ��C����Һ��Ϊ�Ȼ�ɫ��˵���ǽ�����:Cl___Br( �>"��"<")��
(5)��װ��C�еĻ�������װ��C�е���Һ����װ��D�У����۲쵽��������______________��д�����ܷ�����Ӧ�����ӷ���ʽ:_____________________________________дһ�����ɣ������ݴ�����һ����˵����ķǽ����Ա���ǿ��ԭ����___________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����仯������������;��������ʵ������������±���ʾ��
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
�۵�/�� | 85.5 | 115.2 | >600���ֽ⣩ | 75.5 | 16.8 | 10.3 |
�е�/�� | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
�ش��������⣺
��1����̬Oԭ�ӵĵ����Ų�ͼΪ_______����̬Oԭ�ӵ���ռ������ܼ��ĵ���������ͼΪ____�Σ�Oԭ���������ӵ��˶�״̬��_____�֡�
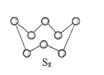
��2����ͼΪS8�Ľṹ���÷�����Sԭ�ӵ��ӻ��������Ϊ______________�����۵�ͷе�Ҫ�ȶ���������۵�ͷе�ߺܶ࣬��Ҫԭ��Ϊ_____________��
��3����̬���������Ե�������ʽ���ڣ�����ӵ����幹��Ϊ_____�Σ��������������д�������ͼ��ʾ�����۷��ӣ��÷�����Sԭ�ӵļ۲������___________��
��4��FeS2����ľ�����ͼ��ʾ����������Fe2+_____������S22-_____����������Fe2+λ��S22-���γɵ�____(���϶����)�����ġ������߳�Ϊa nm��FeS2��Է�������ΪM�������ӵ�������ֵΪNA���侧���ܶȵļ������ʽΪ___________gcm��3��
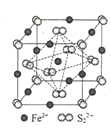
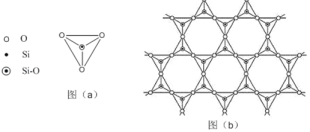
��5���ڹ������У�SiO44�������壨����ͼ��a��ͨ�����ö��������ӿ��γɵ�״����״����״���Ǽ���״�Ĵ���ṹ��ʽ��ͼ��b��Ϊһ��������״�ṹ�Ķ�����������Siԭ�ӵ��ӻ���ʽΪ____���ö������Ļ�ѧʽΪ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ�ý�������ʵ�飬�ܵõ���Ӧʵ����۵���
�� | �� | �� | ʵ����� |
| |
A | Ũ��ˮ | NaOH | ��̪ | NaOH�ļ��Ա� NH3H2O��ǿ | |
B | Ũ���� | MnO2 | ������Һ | �ǽ����ԣ���Ԫ�ش��ڵ�Ԫ�� | |
C | Ũ���� | Na2CO3 | Na2SiO3 | ���ԣ�HNO3 > H2CO3 > H2SiO3 | |
D | Ũ���� | ���� | ��ˮ | Ũ���������ˮ�ԡ������� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص������Һ��˵����ȷ����
A. ��0.1 molL-1CH3COOH��Һ�м�������ˮ����Һ��c��H+��/c��CH3COOH����С
B. �ö��Ե缫���MgCl2��Һ���������ӷ���ʽΪ: 2Cl-+2H2O![]() H2��+Cl2��+2OH-
H2��+Cl2��+2OH-
C. �������м��백ˮ�����ԣ���Һ��c(NH4+)/c(Cl-)>1
D. ��AgCl��AgBr�ı�����Һ�������ϣ��ټ�������AgNO3��Һ�����ɵij���AgCl��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com