
����Ŀ�����仯������������;��������ʵ������������±���ʾ��
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
�۵�/�� | 85.5 | 115.2 | >600���ֽ⣩ | 75.5 | 16.8 | 10.3 |
�е�/�� | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
�ش��������⣺
��1����̬Oԭ�ӵĵ����Ų�ͼΪ_______����̬Oԭ�ӵ���ռ������ܼ��ĵ���������ͼΪ____�Σ�Oԭ���������ӵ��˶�״̬��_____�֡�
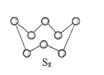
��2����ͼΪS8�Ľṹ���÷�����Sԭ�ӵ��ӻ��������Ϊ______________�����۵�ͷе�Ҫ�ȶ���������۵�ͷе�ߺܶ࣬��Ҫԭ��Ϊ_____________��
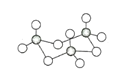
��3����̬���������Ե�������ʽ���ڣ�����ӵ����幹��Ϊ_____�Σ��������������д�������ͼ��ʾ�����۷��ӣ��÷�����Sԭ�ӵļ۲������___________��
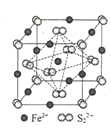
��4��FeS2����ľ�����ͼ��ʾ����������Fe2+_____������S22-_____����������Fe2+λ��S22-���γɵ�____(���϶����)�����ġ������߳�Ϊa nm��FeS2��Է�������ΪM�������ӵ�������ֵΪNA���侧���ܶȵļ������ʽΪ___________gcm��3��
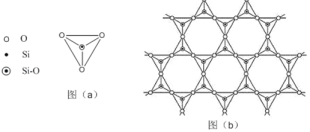
��5���ڹ������У�SiO44�������壨����ͼ��a��ͨ�����ö��������ӿ��γɵ�״����״����״���Ǽ���״�Ĵ���ṹ��ʽ��ͼ��b��Ϊһ��������״�ṹ�Ķ�����������Siԭ�ӵ��ӻ���ʽΪ____���ö������Ļ�ѧʽΪ_____��
���𰸡�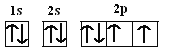 ���壨�Ĵ��� 6 sp3 S8��Է����������Ӽ䷶�»���ǿ ƽ�������� 4 4 4 ��������
���壨�Ĵ��� 6 sp3 S8��Է����������Ӽ䷶�»���ǿ ƽ�������� 4 4 4 �������� ![]() ��1021 sp3 Si2O5��n2n-
��1021 sp3 Si2O5��n2n-
��������
��1������O��̬ԭ�ӵĺ�������Ų�ʽ���
��2���Ƚ��ͼ�ijɼ���Ŀ���µ��Ӷ���Ŀ�ж����ӻ����ͣ��ٸ���Ӱ��S8���Ӿ����۷е�ߵ͵��Ƿ��»����жϣ�
��3�����ݼ۲���ӶԻ������۷�����
��4�����þ�̯���Ծ����е����Ӹ������з������ٸ���![]() ���м��㣻
���м��㣻
��5������ͼ�еļ��ι�ϵ���з�����
��1����̬Oԭ�ӵĵ����Ų�ʽΪ1s22s22p4�����������ӵĵ����Ų�ͼΪ��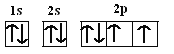 �����ݵ����Ų�ʽ��֪������ռ������ܼ�Ϊ2p�������������ͼΪ���壨�Ĵ����Σ���ͬ�ĵ����˶�״̬������ͬ����Oԭ���������6�����ӣ�����ӵ��˶�״̬��6�֣��ʴ�Ϊ��
�����ݵ����Ų�ʽ��֪������ռ������ܼ�Ϊ2p�������������ͼΪ���壨�Ĵ����Σ���ͬ�ĵ����˶�״̬������ͬ����Oԭ���������6�����ӣ�����ӵ��˶�״̬��6�֣��ʴ�Ϊ��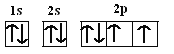 �����壨�Ĵ�����6��
�����壨�Ĵ�����6��
��2��S8��SO2�γɵľ����Ϊ���Ӿ��壬����ͼ���Կ�����S��Χ������Sԭ�ӳɼ���Sԭ�ӻ���2���µ��Ӷԣ�����ӻ�������ۿ�֪���÷�����Sԭ�ӵ��ӻ��������Ϊsp3������������û�������������ʵ��۷е���Ҫ����Է���������Ӱ�죬��ΪS8����Է����������Ӽ䷶�»���ǿ������S8���۷е����SO2���ʴ�Ϊ��sp3��S8��Է����������Ӽ䷶�»���ǿ��
��3����VSEPR���ۣ�SO3��������Ϊ3���µ��Ӷ���Ϊ![]() =0����SO3�ķ��ӹ���Ϊƽ���������Σ��ӻ���ʽΪsp2�ӻ����������������д�����ͼ��ʾ�����۷��ӣ��÷���Sԭ���γ�4�����ۼ������Sԭ�ӵļ۲������Ϊ4���ʴ�Ϊ��ƽ�������ǣ�4��
=0����SO3�ķ��ӹ���Ϊƽ���������Σ��ӻ���ʽΪsp2�ӻ����������������д�����ͼ��ʾ�����۷��ӣ��÷���Sԭ���γ�4�����ۼ������Sԭ�ӵļ۲������Ϊ4���ʴ�Ϊ��ƽ�������ǣ�4��
��4�����ݾ����ṹ��֪�����������ӵĸ���Ϊ![]() ��12+1=4����������Ӹ���Ϊ8��
��12+1=4����������Ӹ���Ϊ8��![]() +6��
+6��![]() =4��������Fe2+λ��S22-���γɵ�������������ġ������߳�Ϊanm��FeS2��Է�������ΪM�������ӵ�������ֵΪNA�������ܶȵļ������ʽΪ��
=4��������Fe2+λ��S22-���γɵ�������������ġ������߳�Ϊanm��FeS2��Է�������ΪM�������ӵ�������ֵΪNA�������ܶȵļ������ʽΪ��![]() ���ʴ�Ϊ��4��4���������壬
���ʴ�Ϊ��4��4���������壬![]() ��1021��
��1021��
��5���������еĹ������SiO44����Ϊ������ṹ��ÿ��Siԭ����Χ����4��Oԭ���������¶Ե��ӣ���������ԭ��Siԭ�Ӳ�ȡ��sp3�ӻ������ݾ����ṹͼ��֪��ͼb�ö���������С�Ľṹ��ԪΪ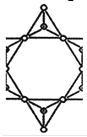 ���ýṹ��Ԫ�к���1+2��
���ýṹ��Ԫ�к���1+2��![]() =2��Siԭ�ӣ�1+1+6��
=2��Siԭ�ӣ�1+1+6��![]() =5��Oԭ�ӣ������������ϼ۵Ĵ�����Ϊ���������������ÿ��������Si-O�е�Oԭ�Ӵ�һ����λ�ĸ���ɣ����Ըö������Ļ�ѧʽΪ(Si2O5��n2n-���ʴ�Ϊ��. sp
=5��Oԭ�ӣ������������ϼ۵Ĵ�����Ϊ���������������ÿ��������Si-O�е�Oԭ�Ӵ�һ����λ�ĸ���ɣ����Ըö������Ļ�ѧʽΪ(Si2O5��n2n-���ʴ�Ϊ��. sp


 ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д�
ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д� ���������ν�ϵ�д�
���������ν�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ClO2��NaClO2������Ư���ԣ���ҵ����ClO2������NaClO2�Ĺ���������ͼ��ʾ��
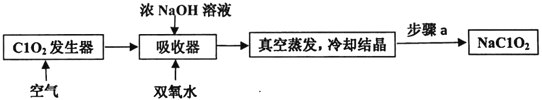
����˵������ȷ����
A. ����a�IJ����������ˡ�ϴ�Ӻ���
B. ������������NaClO2�����ӷ���ʽ��2ClO2+H2O2=2C1O2-+O2��+2H+
C. ��ҵ�Ͽɽ�ClO2�Ƴ�NaClO2���壬�������������
D. ͨ�������Ŀ�������ϳ�ClO2��ʹ�䱻�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ھ����˵���У���ȷ���У� ��
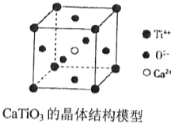
(ͼ��Ca2+��O2-��Ti4+�ֱ�λ������������ġ����ĺͶ���)
�ٷ��Ӿ����ж����ڹ��ۼ����ھ�����ֻҪ�������Ӿ�һ���������Ӣ�嵐��ء��ơ���-�غϽ���۵����ν��͢����Ӿ�����ֻ�����Ӽ�û�й��ۼ������Ӿ����п϶�û�����Ӽ���CaTiO3������(�����ṹ����ͼ��ʾ)ÿ��Ti4+��12��O2-����ڢ�12gʯī�к��е�C-C���ĸ���Ϊ1.5NA(NAΪ�����ӵ�����)�߾����з��Ӽ�������Խ����Խ�ȶ������Ӿ���CaO�ľ����ܱ�KCl��,�۵�KCl��CaO��
A. 2��B. 3��C. 4��D. 5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ��Ǵ���������W��֮�ŵ�һ�ѽ�Կ�� ��1869�꣬�Ž��з�����Ԫ�������ɲ�������Ԫ�����ڱ�����ͼΪԪ�����ڱ���һ���֣��ش��������⡣
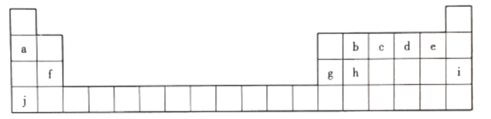
(1).����Ԫ���л�ѧ�������ȶ�����________(��Ԫ�ط��ţ���ͬ) ���ǽ�������ǿ����_____��
(2)c������������Ӧˮ����Ļ�ѧʽΪ__________��
(3)hԪ�ص�ԭ�ӽṹʾ��ͼΪ__________��д��h���ʵ�һ����;:__________��
(4)b��d��f����Ԫ��ԭ�Ӱ뾶�ɴ�С��˳����__________(��Ԫ�ط��ű�ʾ)��
(5)a��g��j�����������м�����ǿ����__________(�ѧʽ)��д������Һ��g�������ﷴӦ�����ӷ���ʽ:___________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A. PCl3�Ŀռ乹��Ϊƽ��������
B. HF��HCl��HBr��HI���۷е���������
C. ����(![]() )��һ�������칹��,��Ϊ������к���һ������̼ԭ��
)��һ�������칹��,��Ϊ������к���һ������̼ԭ��
D. �ȵĸ��ֺ������������ǿ��������ΪHClO>HClO2>HClO3>HClO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2-����ϩΪԭ�ϣ��ϳ��л�����F�ĺϳ�·�����£�
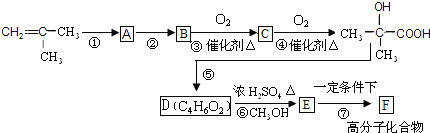
(1)��д��Ӧ���ͣ���Ӧ����____________________����Ӧ����____________��
(2)д���ṹ��ʽ��B_________________ F__________________��
(3)д������D�����������ŵ����ƣ�___________________________��
(4)д����Ӧ�۵Ļ�ѧ����ʽ_____________________________________��
(5)��֪��������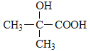 ͬ����ͬ���칹��G����һ�����������γɰ�Ԫ��״�������G���ܵĽṹ��ʽΪ��_____________________________________________________��
ͬ����ͬ���칹��G����һ�����������γɰ�Ԫ��״�������G���ܵĽṹ��ʽΪ��_____________________________________________________��
(6)��ɷ�Ӧ��_________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���������䡶������ּ��������ˡ���ǿˮ���� �����̷�(FeSO47H2O)������������ȥ��Լ�����֮һ������ζͬ��ϸ������������������ �������ȡ���䶨����̳��ҩ��Ϊˮ��������ˮ�����Գ�ˮ��Ω�ƽ�ˮ�У�����������ǿˮ�ù������������������йؽ��ʹ������
A.��������ȥ��Լ�����֮һ��������FeSO44H2O
B.�÷������조ǿˮ��Ϊ����
C.��Ω�ƽ�ˮ�У���������ԭ���Ǽ��� NaCl��Һ����������ǿ
D.��ǿˮ�ù���������ԭ���ǡ�ǿˮ���ù��Ժ���������������Һ���������Լ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ӿ���Ч��ͻ����������ǣ�������ȡ����ͭ���˲��õķ����ǣ� ��
A.Cu+HNO3��Ũ����Cu(NO3)2
B.Cu+HNO3��ϡ����Cu(NO3)2
C.Cu![]() CuO
CuO![]() Cu(NO3)2
Cu(NO3)2
D.Cu+AgNO3��Cu(NO3)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л���ѧ����ʶ�У���ȷ���ǣ� ��
A.![]() �����е��ĸ�̼ԭ�ӿ�����ͬһֱ����
�����е��ĸ�̼ԭ�ӿ�����ͬһֱ����
B.���ۺ���ά�����ڶ��ǣ�������������ˮ��ת��Ϊ�����ǣ�Ϊ�����ṩ����
C.����ʽΪC4H10O���ܺͽ����Ʒ�Ӧ���л��ﹲ�����֣������������칹��
D.�л���C4H8ClBr��ͬ���칹�壨���������칹����12��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com