
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1 molL-1CH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B. 用惰性电极电解MgCl2溶液,电解的离子方程式为: 2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C. 向盐酸中加入氨水至中性,溶液中c(NH4+)/c(Cl-)>1
D. 将AgCl与AgBr的饱和溶液等体积混合,再加入足量AgNO3溶液,生成的沉淀AgCl多
【答案】D
【解析】
A、由电离常数公式可得c(H+)/ c(CH3COOH)=Ka/ c(CH3COO-),稀释时,Ka不变,c(CH3COO-)减小;
B、用惰性电极电解MgCl2溶液时生成氢氧化镁沉淀;
C、中性溶液中c(H+)= c(OH-);
D、当加入足量的浓AgNO3溶液时,AgBr沉淀有所增多,但AgCl沉淀增加更多。
A项、CH3COOH溶液加水稀释,c(CH3COOH)、c(H+)和c(CH3COO-)都减小,电离常数不变,c(H+)/ c(CH3COOH)=Ka/ c(CH3COO-)增大,故A错误;
B项、用惰性电极电解MgCl2溶液,阴极区生成氢氧化镁沉淀和氢气,阳极区生成氯气,反应的离子方程式为Mg2++2Cl-+2H2O![]() Mg(OH)2↓+H2↑+Cl2↑,故B错误;
Mg(OH)2↓+H2↑+Cl2↑,故B错误;
C项、向盐酸中加入氨水至中性,溶液中c(H+)= c(OH-),由电荷守恒关系c(H+)+ c(NH4+)= c(OH-)+ c(Cl-)可知c(NH4+)=c(Cl-),故C错误;
D项、在AgCl和AgBr两饱和溶液中,前者c(Ag+)大于后者c(Ag+),c(Cl-)>c(Br-),当将AgCl、AgBr两饱和溶液混合时,发生沉淀的转化,生成更多的AgBr沉淀,与此同时,溶液中n(Cl-)比原来AgCl饱和溶液中大,当加入足量的浓AgNO3溶液时,AgBr沉淀有所增多,但AgCl沉淀增加更多,故D正确。
故选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】元素周期表是打开物质世界奧秘之门的一把金钥匙 ,1869年,门捷列夫发现了元素周期律并发表了元素周期表。下图为元素周期表的一部分,回答下列问题。
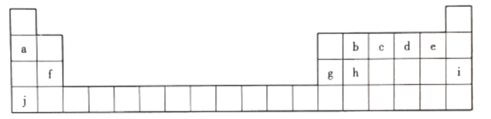
(1).上述元素中化学性质最稳定的是________(填元素符号,下同) ,非金属性最强的是_____。
(2)c的最高价氧化物对应水化物的化学式为__________。
(3)h元素的原子结构示意图为__________,写出h单质的一种用途:__________。
(4)b、d、f三种元素原子半径由大到小的顺序是__________(用元素符号表示)。
(5)a、g、j的氢氧化物中碱性最强的是__________(填化学式),写出其溶液与g的氧化物反应的离子方程式:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从经济效益和环境保护考虑,大量制取硝酸铜最宜采用的方法是( )
A.Cu+HNO3(浓)→Cu(NO3)2
B.Cu+HNO3(稀)→Cu(NO3)2
C.Cu![]() CuO
CuO![]() Cu(NO3)2
Cu(NO3)2
D.Cu+AgNO3→Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,下列说法中不正确的是
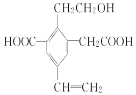
A.1 mol该有机物和过量的金属钠反应最多可以生成1.5 mol H2
B.可以用酸性KMnO4溶液检验其中的碳碳双键
C.该物质能够在催化剂作用下与H2反应,物质的量之比1∶4
D.该物质最多消耗Na、NaOH、NaHCO3的物质的量之比为3∶2∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:① N2 ②Na2O2 ③NaOH ④HCl ⑤H2O2 ⑥MgF2 ⑦NH4Cl。
(1)只由非极性键构成的物质是__________________(填编号)。
(2)由离子键和极性键构成的物质是_______________。
(3)⑤H2O2的电子式为:_________________。
(4)用电子式表示⑥MgF2的形成过程:______________。
(5)下列说法不正确的是________。
①共价化合物中含共价键,也可能含离子键
②因为H2CO3酸性<H2SO3酸性,所以非金属性C<S
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤熔融状态能导电的物质是离子化合物
⑥由分子组成的化合物中一定存在共价键
A. ①③⑤ B. ①②⑥ C. ①②④⑤ D. ①③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电池接通后,向乙中滴入酚酞溶液,在F极附近溶液显红色。则以下说法正确的是

A.电源B极是正极
B.甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1∶2∶2∶1
C.欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D.装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化学的认识中,正确的是( )
A.![]() 分子中的四个碳原子可能在同一直线上
分子中的四个碳原子可能在同一直线上
B.淀粉和纤维素属于多糖,均可在人体内水解转化为葡萄糖,为人类提供能量
C.分子式为C4H10O且能和金属钠反应的有机物共有三种(不考虑立体异构)
D.有机物C4H8ClBr的同分异构体(不含立体异构)有12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe(OH)2在空气中容易变质。某同学欲利用如图所示装置制取能较长时间存在的Fe(OH)2,其中实验所用溶液现配现用且蒸馏水先加热煮沸。请回答下列问题:
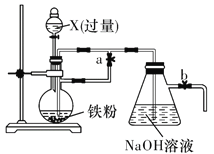
(1)X可以是________(填字母代号)。
A.稀硫酸 B.浓硫酸
C.稀硝酸 D.稀盐酸
(2)实验开始时,向烧瓶中加入X前,应________(填字母代号)。
A.先关闭止水夹a、b B.先打开止水夹a、b
C.先关闭止水夹b、打开a D.先关闭止水夹a、打开b.
(3)烧瓶中发生反应的离子方程式为___________________________________________。
(4)反应一会后,在b导管口收集检验氢气纯净后,关闭______(填“a”或“b”),一段时间后,可在烧瓶中观察到的现象是_________________________________________________________。
(5)反应结束后,为确保Fe(OH)2可较长时间存在,则应关闭分液漏斗活塞和止水夹________(填“a”或“b”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①—⑨在表中的位置,回答问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中⑧元素单质可用作________。
(2)③、④、⑧的原子半径最小是________(用元素符号回答)。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物中,碱性最强的是________(用化学式回答)。
(4)②、③、④的气态氢化物中,稳定性最弱的是________(用化学式回答)(5)②和③按原子数![]() 形成的化合物的电子式为________,该晶体气化的过程中克服的微粒间作用力为________。
形成的化合物的电子式为________,该晶体气化的过程中克服的微粒间作用力为________。
(6)③和⑧形成的化合物属于________(填“离子化合物”或“共价化合物”),该晶体属于________晶体(填“离子”、“分子”、“原子”)。
(7)元素⑤、⑦的最高价氧化物的水化物互相反应的化学方程式为:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com