
����Ŀ���ں��º��������У�2NO2 ![]() 2NO��O2������˵����Ӧ��ƽ��״̬���ǣ�
2NO��O2������˵����Ӧ��ƽ��״̬���ǣ�
�ٵ�λʱ��������n mol O2��ͬʱ����2n mol NO2�� �ڵ�λʱ��������n mol O2 ��ͬʱ������2n mol NO�� ��NO2��NO��O2 �ķ�Ӧ���ʵı�Ϊ2 : 2 : 1��״̬�� �ܻ���������ɫ���ٸı��״̬�� �ݻ��������ܶȲ��ٸı��״̬�� ��������ƽ����Է����������ٸı��״̬��
A. �٢ܢ�B. �ڢۢ�C. �٢ۢ�D. �٢ڢۢܢݢ�
���𰸡�B
��������
�ٵ�λʱ��������n mol O2��ͬʱ����2n mol NO2��ʾ���淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬����ȷ���ڸ��ݷ���ʽ������n mol O2 ��ͬʱһ������2n mol NO������˵����Ӧ�ﵽƽ��״̬�����۸��ݷ���ʽ����Ϊͬһ�������κ�ʱ��NO2��NO��O2 �ķ�Ӧ���ʵıȶ�����2 : 2 : 1������˵����Ӧ�ﵽƽ��״̬�����ܷ�Ӧ��ֻ�ж�����������ɫ������������ɫ���ٸı䣬˵������������Ũ�Ȳ��䣬��Ӧ�ﵽƽ��״̬����ȷ����������������䣬������������䣬���������ܶ�ʼ�ղ��䣬����˵����Ӧ�ﵽƽ��״̬������Ӧǰ����������ʵ��������仯��������������䣬��������ƽ����Է����������ŷ�Ӧ�Ľ��з����仯������������ƽ����Է����������䣬��Ӧ�ﵽƽ��״̬����ȷ����Ӧ��ƽ��״̬���Т٢ܢޣ�����˵����Ӧ��ƽ��״̬���Тڢۢݣ���ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͨ��10 g ����ͭ��ĩ����Ƭ������ȴ��ʣ����������Ϊ8.4 g�����м�����ȷ����
A. ��1.6 g ˮ����
B. ��8.4 g ͭ����
C. ��80%������ͭ����ԭ
D. ʵ��ʱ�����ĵ���������0.2 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��ȡ 9 g ��������ˮ���ⶨ���۵�ˮ��ٷ��ʣ���������£�
![]()
(1)�������ӵ��Լ�AΪ__________��B__________��C__________��
(2)________(����ԡ������ԡ�)ֻ��A��Һ������B��Һ��ԭ����____________________��
(3)������2.16g���ʳ���ʱ�����۵�ˮ����Ϊ_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʲ�������Ȼ�߷��ӻ��������
A. ���� B. ���� C. ������ D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ΪVA��Ԫ�أ�����ұ�����̲����ĺ����ж��������账�����⡣
I��ұ����ˮ����Ԫ����Ҫ��������(H3AsO3)��ʽ���ڣ����û�ѧ�������������Ը�Ũ�Ⱥ����ˮ���乤���������£�
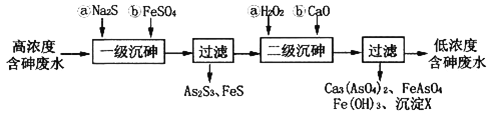
��֪����As2S3�������S2���������·�Ӧ��As2S3(s)+3S2��(aq) ![]() 2AsS33��(aq)��
2AsS33��(aq)��
���������ε��ܽ��Դ�����Ӧ�����Ρ�
��1������������Ԫ�صĻ��ϼ�Ϊ________������ĵ�һ�����뷽��ʽΪ________________________��
��2����һ����������FeSO4��������___________����������������H2O2�뺬�����ʷ�Ӧ�Ļ�ѧ����ʽΪ______________________________________________________________��
��3������XΪ___________(�ѧʽ)��
����ұ�������е���Ԫ����Ҫ��As2S3����ʽ���ڣ����ù������鷨�붨�����(As����ͼ����Ϊ3.0��10��6g)��
����1��ȡ10g������Ʒ���������п�ۻ�ϣ�����H2SO4���ȣ�����AsH3���塣
����2����AsH3����ͨ��AgNO3��Һ�У�����������As2O3��
����3��ȡ1g������Ʒ���ظ�����ʵ�飬δ���������ɡ�
��4��AsH3�ĵ���ʽΪ_______________.
��5������2�����ӷ���ʽΪ______________________________________________��
��6�������������ŷű��У���Ԫ�ز��ø���4.0��10��5g��kg��1������ŷŵķ�������Ԫ�صĺ���_______(����������������������)�ŷű�.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶���,��2 L���ܱ�������,X��Y��Z�������������ʱ��仯��������ͼ��ʾ:

(1)�ӷ�Ӧ��ʼ��10 sʱ,��Z��ʾ�ķ�Ӧ����Ϊ����������������,X�����ʵ���Ũ�ȼ�������������,Y��ת����Ϊ������
(2)�÷�Ӧ�Ļ�ѧ����ʽΪ��
(3)10 s���ijһʱ��(t1)�ı����������,��������ʱ��ı仯ͼ����ͼ��ʾ:

������˵�����ϸ�ͼ���������������
A.t1ʱ��,������X��Ũ�� B.t1ʱ��,��������ϵ�¶�
C.t1ʱ��,��С��������� D.t1ʱ��,ʹ���˴���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ����д
(1)�����ĵ���ʽ��_________����Ȳ�Ľṹ��ʽ��___________��
(2)��ҵ��������ϩ��ˮ������ȡ�Ҵ�����ѧ��Ӧ����ʽ��________��Ӧ���ͣ�____________
(3)����Ũ������50~60���·���������Ӧ��________��Ӧ���ͣ�_____________��
(4)��֪�������£�
��ѧ�� | H��H | N��N | N��H | N��N |
����kJ/mol | 432 | 247 | 389 | 942 |
д��N2��H2�ϳ�NH3���Ȼ�ѧ����ʽ��_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����27.2 g Cu��Cu2O�Ļ�����м���ijŨ�ȵ�2Lϡ���ᣬ����������ȫ��Ӧ������NO��Cu(NO3)2����������Һ�м���2.0 mol��L��1��NaOH��Һ1.0 L����ʱ��Һ�����ԣ�������������ȫ��������������Ϊ39.2 g�������й�˵����ȷ����(����)
A. Cu��Cu2O�����ʵ���֮��Ϊ1��1
B. ��������ʵ���Ũ��Ϊ1 mol��L��1
C. ������NO�����Ϊ4.48 L
D. Cu��Cu2O�����ᷴӦ��ʣ��HNO3Ϊ1.2 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ����ƣ��ܴﵽʵ��Ŀ�ĵ���
A.���Ҵ���ȡ��ˮ�е��嵥��
B.�÷�Һ©����ʳ���з��������
C.������ķ����ӹ�ҵ�ƾ�����ȡ�Ҵ�
D.��ʳ��ˮ���½ᾧ���NaCl����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com