
【题目】按要求书写
(1)氨气的电子式:_________,乙炔的结构简式:___________;
(2)工业上利用乙烯催化水化法制取乙醇,化学反应方程式:________反应类型:____________
(3)苯与浓硝酸在50~60℃下发生硝化反应:________反应类型:_____________;
(4)已知键能如下:
化学键 | H—H | N—N | N—H | N≡N |
键能kJ/mol | 432 | 247 | 389 | 942 |
写出N2和H2合成NH3的热化学方程式:_____________。
【答案】![]() CH≡CH CH2=CH2+H2O
CH≡CH CH2=CH2+H2O![]() CH3CH2OH 加成
CH3CH2OH 加成 ![]() +HNO3
+HNO3![]()
![]() +H2O 取代 N2(g)+3H2(g)
+H2O 取代 N2(g)+3H2(g)![]() 2NH3(g);△H=-96kJ/mol
2NH3(g);△H=-96kJ/mol
【解析】
(1)N原子与3个H原子形成3个共价键;乙炔分子中2个C原子形成3个共价键,每个C原子与H原子形成1个共价键;
(2)乙烯与水发生加成反应制取乙醇;
(3)苯与浓硝酸在50~60℃下发生取代反应才硝基苯和水;
(4)根据反应热为断键吸收热量与成键放出热量的差计算。
(1)N原子最外层有5个电子,有三个成单电子分别与3个H原子形成3个共价键,所以NH3的电子式为![]() ;乙炔分子中2个C原子之间形成3个共价键,每个C原子与1个H原子形成1个共价键,因此乙炔的乙炔的结构简式为CH≡CH;
;乙炔分子中2个C原子之间形成3个共价键,每个C原子与1个H原子形成1个共价键,因此乙炔的乙炔的结构简式为CH≡CH;
(2)乙烯与水在催化剂存在和加热时发生加成反应产生乙醇,反应方程式为:CH2=CH2+ H2O ![]() CH3CH2OH,反应类型为加成反应;
CH3CH2OH,反应类型为加成反应;
(3)苯与浓硝酸在50~60℃下发生取代反应才硝基苯和水,反应方程式为:![]() +HNO3
+HNO3![]()
![]() +H2O,反应类型为取代反应;
+H2O,反应类型为取代反应;
(4)N2与H2合成氨气的反应方程式为N2+3H2![]() 2NH3;根据反应热的含义为断裂反应物的化学键吸收热量与形成生成物的化学键放出热量的差,可知该反应的反应热为942+3×432-6×389=-96kJ/mol,所以该反应的热化学方程式为N2(g)+3H2(g)
2NH3;根据反应热的含义为断裂反应物的化学键吸收热量与形成生成物的化学键放出热量的差,可知该反应的反应热为942+3×432-6×389=-96kJ/mol,所以该反应的热化学方程式为N2(g)+3H2(g)![]() 2NH3(g);△H=-96kJ/mol。
2NH3(g);△H=-96kJ/mol。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某恒温密闭容器发生可逆反应:Z(?)+W(?)![]() X(g)+Y(?)ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是( )
X(g)+Y(?)ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是( )
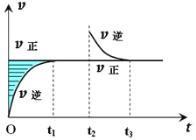
A. Z和W在该条件下至少有一个是为气态
B. 若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等
C. t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量可能相等也可能不等
D. 若该反应只在某温度T以上自发进行,则该反应的平衡常数K随温度升高而减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于A2+3B2 ![]() 2C的反应来说,以下化学反应速率的表示中,反应速度最慢的是
2C的反应来说,以下化学反应速率的表示中,反应速度最慢的是
A. v(B2)=0.8 mol/(L·s)B. v(B2)= 3mol/(L·min)
C. v(C)=0.6 mol/(L·s)D. v(A2)=0.4 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容容器中:2NO2 ![]() 2NO+O2。不能说明反应达平衡状态的是:
2NO+O2。不能说明反应达平衡状态的是:
①单位时间内生成n mol O2的同时生成2n mol NO2; ②单位时间内生成n mol O2 的同时,生成2n mol NO; ③NO2、NO、O2 的反应速率的比为2 : 2 : 1的状态; ④混合气体的颜色不再改变的状态; ⑤混合气体的密度不再改变的状态; ⑥混合气体的平均相对分子质量不再改变的状态。
A. ①④⑥B. ②③⑤C. ①③④D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为解决能源短缺问题,工业生产中应合理利用化学能。
(1)25℃,1.01×105Pa时,实验测得,4g氢气在O2中完全燃烧生成液态水,放出572kJ的热量,则表示H2的燃烧热的热化学方程式为________________________________。
(2)下图是某笔记本电脑使用的甲醇燃料电池的结构示意图。放电时甲醇应从_________处通入(填“a”或“b”),电池内部H+向_________(填“左”或“右”)移动。写出电池负极的电极反应式_________________________________。
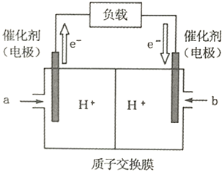
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。
化学键 | H-H | N-H | N≡N |
键能/ kJ·mol-1 | 436 | a | 945 |
已知:N2(g)+3H2(g)=2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据计算a的数值__________。
(4)已知:C(s,石墨)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1 ①
2H2(g)+O2(g)=2H2O(1) △H2=-571.6 kJ·mol-1 ②
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(1) △H3=-2599 kJ·mol-1 ③
根据盖斯定律,计算反应2C(s,石墨)+H2(g)=C2H2(g)的△H=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于SiO2的说法中错误的是
A.纯净的SiO2是光纤制品的基本原料
B.SiO2能与NaOH溶液反应生成盐
C.SiO2高温下能与CaO反应生成盐
D.SiO2能与氢氟酸反应,因此它属于碱性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子层结构,则下列有关说法中,不正确的是( )
A.1 mol NH5中含有5NA个N—H键(NA表示阿伏加德罗常数)
B.NH5中既有共价键又有离子键,NH5是离子化合物
C.NH5的电子式为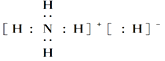
D.它与水反应的化学方程式为NH5+H2O===NH3·H2O+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火法炼铜得到的粗铜中含有多种杂质(如锌、金和银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯。在电解精炼时( )
A. 粗铜接电源负极
B. 杂质都将以单质形式沉积到池底
C. 粗铜作阴极
D. 纯铜片增重2.56 g,电路中通过电子的物质的量为0.08 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应: 2 A(g) + B(g) ![]() 3 C(g) + D(g)。试根据下图判断正确的是
3 C(g) + D(g)。试根据下图判断正确的是

A. 温度T1℃ 比 T2℃高
B. 正反应为放热反应
C. 甲图纵轴可以表示A的转化率
D. 甲图纵轴可以表示混合气体平均相对分子质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com