
【题目】某学习小组根据高中知识设计如下测定室内甲醛含量的装置(夹持及尾气处理等装置已略)。

Ⅰ.配制银氨溶液
(1)关闭K2和K3,打开K1和分液漏斗活塞,将饱和食盐水滴入到圆底烧瓶中,当观察到三颈烧瓶中最初生成的白色沉淀恰好完全溶解时,关闭K1和分液漏斗活塞。请写出三颈烧瓶中生成银氨溶液的化学方程式________________________。
II.测定室内空气中甲醛含量
(2)装置中毛细管的作用是________________________________________________。
(3)用热水浴加热三颈烧瓶,打开K3,将滑动隔板由最左端抽到最右端,吸入1L室内空气,关闭K3,后续操作是_________________________________________。共计进行上述操作十次。
(4)待甲醛充分被银氨溶液氧化为碳酸盐后,测得三颈瓶中共生成Ag 2.16mg。则空气中甲醛的含量为___________mg·L-1(空气中其它物质不与银氨溶液反应)。
【答案】AgNO3+3NH3·H2O=Ag(NH3)2OH+NH4NO3+2H2O或AgNO3+NH3·H2O=AgOH↓+NH4NO3、AgOH+2NH3·H2O=Ag(NH3)2OH+2H2O 减小气体通入速率,使空气中甲醛气体被完全吸收 打开K2,缓慢推动滑动隔板,将气体全部推出,再关闭K2 0.015或1.5×10—2
【解析】
(1)A中饱和食盐水和氮化镁反应制取氨气,氨气通入硝酸银溶液中制备银氨溶液,三颈烧瓶中生成银氨溶液的化学方程式为AgNO3+3NH3·H2O=Ag(NH3)2OH+NH4NO3+2H2O;
(2)装置中毛细管的作用是减小气体通入速率,使空气中甲醛气体被完全吸收;
(3)用热水浴加热三颈烧瓶,打开K3,将滑动隔板由最左端抽到最右端,吸入1L室内空气,关闭K3,后续操作是打开K2,缓慢推动滑动隔板,将气体全部推出,再关闭K2;
(4)甲醛和银氨溶液反应生成银和碳酸盐,根据甲醛被氧化为碳酸盐,氢氧化二氨合银被还原为单质银,甲醛中碳元素化合价由0价→+4价,银由+1价→0价,生成Ag 2.16mg,
根据电子守恒规律:设消耗甲醛的物质的量为x,则4x=![]() =2×10-5mol,x=5×10-6mol,因为实验进行了10次操作,所以测得1L空气中甲醛的含量为5×10-7mol,即为5×10-7×30×103mg/L=0.015mg·L-1。
=2×10-5mol,x=5×10-6mol,因为实验进行了10次操作,所以测得1L空气中甲醛的含量为5×10-7mol,即为5×10-7×30×103mg/L=0.015mg·L-1。
(1)A中饱和食盐水和氮化镁反应制取氨气,氨气通入硝酸银溶液中制备银氨溶液,三颈烧瓶中生成银氨溶液的化学方程式为AgNO3+3NH3·H2O=Ag(NH3)2OH+NH4NO3+2H2O;
故答案为:AgNO3+3NH3·H2O=Ag(NH3)2OH+NH4NO3+2H2O;
(2)装置中毛细管的作用是减小气体通入速率,使空气中甲醛气体被完全吸收,
故答案为:减小气体通入速率,使空气中甲醛气体被完全吸收;
(3)用热水浴加热三颈烧瓶,打开K3,将滑动隔板由最左端抽到最右端,吸入1L室内空气,关闭K3,后续操作是打开K2,缓慢推动滑动隔板,将气体全部推出,再关闭K2,
故答案为:打开K2,缓慢推动滑动隔板,将气体全部推出,再关闭K2;
(4)甲醛和银氨溶液反应生成银和碳酸盐,根据甲醛被氧化为碳酸盐,氢氧化二氨合银被还原为单质银,甲醛中碳元素化合价由0价→+4价,银由+1价→0价,生成Ag 2.16mg,
根据电子守恒规律:设消耗甲醛的物质的量为x,则4x=![]() =2×10-5mol,x=5×10-6mol,因为实验进行了10次操作,所以测得1L空气中甲醛的含量为5×10-7mol,即为5×10-7×30×103mg/L=0.015mg·L-1。
=2×10-5mol,x=5×10-6mol,因为实验进行了10次操作,所以测得1L空气中甲醛的含量为5×10-7mol,即为5×10-7×30×103mg/L=0.015mg·L-1。
故答案为:0.015。


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】在200mL2molL-1NaOH溶液中通入标准状况下6.72L二氧化碳气体,完全反应后所得溶液中:
(1)完全反应后所得溶液的溶质为______。
(2)在所得溶液中加入0.5molL-1的盐酸,至少加入______mL后才会有CO2气体放出。(不考虑CO2溶解于水)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中a、b、c、d、e、f表示元素周期表中部分短周期元素,下列叙述正确的是( )

A.a、b、c的简单离子中,b的离子半径最大
B.c、d、f最高价氧化物对应的水化物两两之间均可发生反应
C.e的氢化物比f的氢化物的稳定性高
D.b、e可形成一种半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol·L-1 CuCl2溶液中滴加0.1 mol·L-1的Na2S溶液,滴加过程中-lg c(Cu2+)与Na2S溶液体积的关系如图所示。下列有关说法正确的是
已知:Ksp(ZnS)=3×10-25
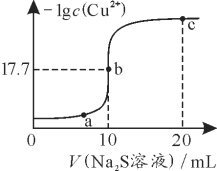
A. Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
B. a、b、c三点对应的溶液中,水的电离程度最大的为b点
C. 该温度下,Ksp(CuS)=1×10-35.4
D. 向100 mL Zn2+、Cu2+物质的量浓度均为0.1mol·L-1的混合溶液中逐滴加入10-3 mol·L-1的Na2S溶液,Zn2+先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.最高正化合物:P>N>C
B.第一电离能:Li>Na>K
C.热稳定性:H2O>HF>H2S
D.碱性:LiOH>NaOH>KOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种不同物质之间具有如图所示转化关系(反应条件及部分产物已略去)。下列有关物质的推断不正确的是 ( )

选项 | 假设 | 结论 |
A | A为NaOH溶液 | D可能是CO2 |
B | B为CO | C可能是CO2 |
C | C为FeCl2 ,D为Fe | A可能是盐酸 |
D | C为SO2 | A可能是H2S |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷、硫、氯、砷等是农药中的重要组成元素。回答下列问题:
(1)基态砷原子的核外价电子排布式为___________。
(2)生产农药的原料PSCl3中P、S、Cl的第一电离能由大到小的顺序为_____________,电负性由大到小的顺序为__________________________________________________。
(3)H2O 与H2S为同族元素的氢化物,H2O可以形成H3O+或H9O4+等,而H2S几乎不能形成类似的H3S+或H9S4+,其原因是_________________________________________。
(4)COS(羰基硫)可用作粮食的熏蒸剂,其中碳原子的杂化轨道类型为_____________,所含共价键的类型为_____________,N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,则N2O的电子式为________________________________________。
(5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2000℃ ,其晶胞结构如图所示。
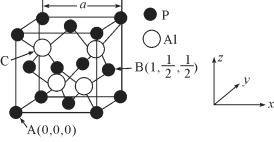
①磷化铝的晶体类型为_____________。
②A、B点的原子坐标如图所示,则C点的原子坐标为_____________。
③磷化铝的晶胞参数a=546.35pm(1pm=10-12m),其密度为_____________(列出计算式即可,用NA表示阿伏加德罗常数的数值)g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 标准状况下,将22.4LHCl溶于足量水中,溶液中含有的HCl分子数为NA
B. 常温常压下,16g14CH4所含中子数目为8NA
C. 常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA
D. 标准状况下,22.4L空气含有NA个单质分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com