
【题目】在200mL2molL-1NaOH溶液中通入标准状况下6.72L二氧化碳气体,完全反应后所得溶液中:
(1)完全反应后所得溶液的溶质为______。
(2)在所得溶液中加入0.5molL-1的盐酸,至少加入______mL后才会有CO2气体放出。(不考虑CO2溶解于水)
【答案】Na2CO3和NaHCO3 200
【解析】
200mL2mol/L的NaOH溶液中n(NaOH)=cV=0.2L×2molL-1=0.4mol,n(CO2)=![]() =
=![]() =0.3mol,n(CO2):n(NaOH)=3:4,
=0.3mol,n(CO2):n(NaOH)=3:4,
(1)少量的CO2与过量NaOH反应时:CO2+2NaOH=Na2CO3+H2O,则n(CO2):n(NaOH)=1:2,过量的CO2与过量NaOH反应时:CO2+NaOH=NaHCO3,则n(CO2):n(NaOH)=1:1,而![]() <
<![]() <1,说明CO2一部分生成Na2CO3,一部分生成NaHCO3,即所得溶液的溶质为Na2CO3和NaHCO3的混合物;
<1,说明CO2一部分生成Na2CO3,一部分生成NaHCO3,即所得溶液的溶质为Na2CO3和NaHCO3的混合物;
(2)0.3mol与0.4molNaOH反应生成Na2CO3和NaHCO3,根据Na和C守恒有n(Na2CO3)+n(NaHCO3)=0.3,2n(Na2CO3)+n(NaHCO3)=0.4,所以n(Na2CO3)=0.1mol,n(NaHCO3)=0.2mol,而Na2CO3+HCl=NaCl+NaHCO3,当Na2CO3完全转化为NaHCO3时,HCl的量为最小量,即(HCl)=n(Na2CO3)=0.1mol=0.5molL-1×V(HCl),所以V(HCl)=0.2L=200mL。


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ(1)燃料电池是一种高效、环境友好的发电装置。氢氧燃料电池已用于航天飞机。以氢氧化钾溶液为电解质溶液的这种电池的负极反应式为_______________,这种电池在放电使用一段时间后,电解质溶液中的c(OHˉ)将___________(填“增大”“减小” 或“不变”)。
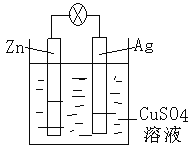
(2)如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液。回答下列问题:锌为_______极,该电极上发生_________反应(“氧化”或“还原”),电极反应式为__________,该原电池的总反应离子方程式为__________________________________。
Ⅱ.一定温度下将6mol的A及6molB混合于2L的密闭容器中,发生如下反:3A(g)+B(g)![]() xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36mol/(L·min)。求:
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36mol/(L·min)。求:
(1)平衡时D的浓度=________。
(2)B的平均反应速率v(B)=____________。
(3)x=________________。
(4)开始时容器中的压强与平衡时的压强之比为_______(化为最简整数比)。
(5)以NH3代替氢气研发燃料电池是当前科研的一个热点。使用的电解质溶液是2mol·L-1的KOH溶液,电池总反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应__________;每消耗3.4gNH3转移的电子数目为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物a( )、b(
)、b(![]() -CH3)、c(
-CH3)、c(![]() )的说法正确的是
)的说法正确的是
A. a、b互为同分异构体 B. b、c均属于芳香化合物
C. c分子中所有碳原子共平面 D. a、b、c均能与溴水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.24g镁在足量空气中充分燃烧时转移电子数大于![]()
B.![]() 氯气溶于足量NaOH溶液,转移的电子数为
氯气溶于足量NaOH溶液,转移的电子数为![]()
C.标准状况下,![]() 中含有的原子数目为
中含有的原子数目为![]()
D.常温常压下,![]() 和
和![]() 的混合气体中含有的原子数为
的混合气体中含有的原子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:①NaClO溶液;②Cu;③稀硫酸;④BaSO4;⑤乙醇;⑥SiO2;⑦乙烯;⑧熔融的KCl;⑨石墨;⑩冰醋酸。回答下列问题:
(1)上述物质中属于电解质的是______。(填写序号,以下同)
(2)上述物质中可以导电的是______。
(3)写出在催化剂存在条件下⑦转化为⑤的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是人体细胞中三种重要有机物A、C、E的元素组成及相互关系图,请据图回答:

(1)图中X所指的元素为________。
(2)A的中文名称为____________,其彻底水解的产物有___种。
(3)细胞结构Ⅱ的名称为________,在细胞中分布场所为________,主要作用有__________、______。
(4)过程②叫做________,若b的平均相对分子质量为r,通过②反应过程形成m条肽链,经盘曲折叠构成相对分子质量为e的E,则E分子中肽键的数目是________。E具有多样性,其原因由b分析为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图A、B、C表示生物大分子,请分析推断并回答有关问题:

(1)请依次写出上图中X、Y所代表的元素:X为_______,Y为____。
(2)图中大分子物质A的中文名称是__________,其合成所需原料是_____________。
(3)B具有多样性,若从b分析其原因是_______________________________。若b的平均相对分子质量为110,通过②反应过程形成2条肽链,经盘曲折叠构成相对分子质量为3900的B,则B分子中肽键的数目是____。
(4)同一个人的肝细胞与骨骼肌细胞相比,A、B是否相同?________。
(5)导致地球上生物多种多样的根本原因是[]____的结构具有多样性。
(6)医学上进行器官移植时,和免疫排斥反应直接有关的结构是图中的___________。
(7)使用下列哪种物质处理会使细胞失去识别能力 (______)
A.核酸酶B.糖水解酶C.龙胆紫D.双缩脲试剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积不变的密闭容器中发生化学反应:2A(g) ![]() B(g)+C(g)。当物质A的起始浓度为1.0 mol·L-1、物质B、C的起始浓度为0时,物质A的浓度、转化率以及物质B的浓度随反应时间的变化如下列各图所示:
B(g)+C(g)。当物质A的起始浓度为1.0 mol·L-1、物质B、C的起始浓度为0时,物质A的浓度、转化率以及物质B的浓度随反应时间的变化如下列各图所示:

则下列有关说法中正确的是
A. 条件I、条件II时的反应温度不同,压强相同
B. 条件I时可能未使用催化剂,条件II时可能使用了催化剂
C. 条件III时的平衡混合物中,物质C的浓度等于0.6 mol·L-1
D. 条件IV和条件II相比较,条件IV时可能缩小了容器体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组根据高中知识设计如下测定室内甲醛含量的装置(夹持及尾气处理等装置已略)。

Ⅰ.配制银氨溶液
(1)关闭K2和K3,打开K1和分液漏斗活塞,将饱和食盐水滴入到圆底烧瓶中,当观察到三颈烧瓶中最初生成的白色沉淀恰好完全溶解时,关闭K1和分液漏斗活塞。请写出三颈烧瓶中生成银氨溶液的化学方程式________________________。
II.测定室内空气中甲醛含量
(2)装置中毛细管的作用是________________________________________________。
(3)用热水浴加热三颈烧瓶,打开K3,将滑动隔板由最左端抽到最右端,吸入1L室内空气,关闭K3,后续操作是_________________________________________。共计进行上述操作十次。
(4)待甲醛充分被银氨溶液氧化为碳酸盐后,测得三颈瓶中共生成Ag 2.16mg。则空气中甲醛的含量为___________mg·L-1(空气中其它物质不与银氨溶液反应)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com