
����Ŀ����1��ȼ�ϵ����һ�ָ�Ч�������Ѻõķ���װ�á�����ȼ�ϵ�������ں���ɻ���������������ҺΪ�������Һ�����ֵ�صĸ�����ӦʽΪ_______________�����ֵ���ڷŵ�ʹ��һ��ʱ��������Һ�е�c��OH������___________���������С�� ���䡱����
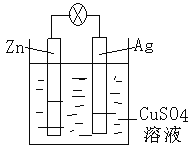
��2����ͼ����пԭ���װ�õ�ʾ��ͼ��������ͭΪ�������Һ���ش��������⣺пΪ_______�����õ缫�Ϸ���_________��Ӧ������������ԭ�������缫��ӦʽΪ__________����ԭ��ص��ܷ�Ӧ���ӷ���ʽΪ__________________________________��
��.һ���¶��½�6mol��A��6molB�����2L���ܱ�������,�������·�:3A��g��+B��g��![]() xC��g��+2D��g��,����5���Ӻ�Ӧ�ﵽƽ��,���A��ת����Ϊ60%,C��ƽ����Ӧ������0.36mol/��L��min������:
xC��g��+2D��g��,����5���Ӻ�Ӧ�ﵽƽ��,���A��ת����Ϊ60%,C��ƽ����Ӧ������0.36mol/��L��min������:
��1��ƽ��ʱD��Ũ��=________��
��2��B��ƽ����Ӧ����v��B��=____________��
��3��x=________________��
��4����ʼʱ�����е�ѹǿ��ƽ��ʱ��ѹǿ֮��Ϊ_______����Ϊ��������ȣ���
��5����NH3���������з�ȼ�ϵ���ǵ�ǰ���е�һ���ȵ㡣ʹ�õĵ������Һ��2mol��L-1��KOH��Һ������ܷ�ӦΪ��4NH3+3O2��2N2+6H2O���õ�ظ����ĵ缫��Ӧ__________��ÿ����3.4gNH3ת�Ƶĵ�����ĿΪ__________��
���𰸡�2H2+4OH��-4e����4H2O ��С ���� ���� Zn-2e-��Zn2+ Zn+Cu2+��Cu+Zn2+ 1.2mol/L 0.12mol/��L��min�� 3 10:11 2NH3-6e-+6OH-��N2+6H2O 0.6NA
��������
��.��1��ͨ��������һ��Ϊ��صĸ���������ʧ���ӷ���������Ӧ������ˮ�����ĵ缫����ʽΪ2H2+4OH--4e-��4H2O������ʱ���ܷ�ӦΪ2H2+O2��2H2O����Ӧ����ˮ��Һ�����������c��OH-������С��
��2����ͼ��֪��ZnΪ�����������ϵ缫��ӦʽΪZn-2e-=Zn2+��ʧȥ���ӱ�������Ϊ������Ӧ��AgΪ�����������ϵ缫��ӦʽΪCu2++2e-=Cu����ԭ��ص��ܷ�Ӧ���ӷ���ʽΪZn+Cu2+=Cu+Zn2+��
��.��Ӧ3A��g��+B��g��![]() xC��g��+2D��g������5���Ӻ�Ӧ�ﵽƽ�⣬���A��ת����Ϊ60%����
xC��g��+2D��g������5���Ӻ�Ӧ�ﵽƽ�⣬���A��ת����Ϊ60%����
3A��g��+B��g��![]() xC��g��+2D��g��
xC��g��+2D��g��
��ʼ��mol/L��3 3 0 0
ת����mol/L��3��60% 0.6 0.6x 1.2
ƽ�⣨mol/L��1.2 2.4 0.6x 1.2
��1��������������֪ƽ��״̬D��Ũ��Ϊ1.2mol/L���ʴ�Ϊ��1.2��
��2��B��ƽ����Ӧ��������B��=0.6mol/L��5min=0.12mol/��L��min����
��3��������֮�ȵ��ڻ�ѧ������֮�ȿ�֪��1/x=0.12/0.36�����x=3��
��4����ʼʱ�����е�ѹǿ��ƽ��ʱ��ѹǿ֮�ȵ��ڷ�Ӧǰ������ʵ���֮�͵ıȣ�Ϊ��6+6��mol����1.2+2.4+0.6��3+1.2��mol/L��2L=10��11���ʴ�Ϊ��10��11��
��5����ط�ӦΪ��4NH3+3O2=2N2+6H2O���õ�ظ����ǰ���ʧ�������ɵ�������Ӧ�ĵ缫��ӦʽΪ2NH3+6OH--6e-=N2+6H2O����Ӧ��2mol������Ӧ����ת��6mol���ӣ�ÿ����3.4g NH3���ʵ���0.2nol��ת�Ƶĵ�����Ϊ0.6NA��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
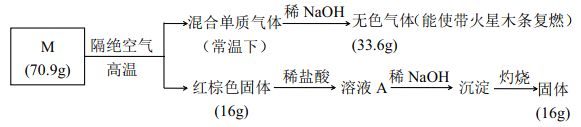
����Ŀ��Ϊ����ij�εijɷ֣� ��������ʵ�飺
��ش�
��1���� M �Ļ�ѧʽ��_________��
��2���� NaOH ���յ�����ĵ���ʽ____________��
��3������Һ A ��ͨ��H2S ���壬 �е���ɫ���������� д����Ӧ�����ӷ���ʽ________ (�����ǿ�����Ӱ��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ����(N2H4��H2O)����ɫ����ǿ��ԭ�Ե�Һ�壬ʵ�����Ƹ�ˮ���µ�ԭ��Ϊ��CO(NH2)2+2NaOH+NaC1O=Na2CO3+N2H4��H2O+NaCl �ݴˣ�ijѧ�����������ʵ�顣
����1���Ʊ�NaC1O��Һ����֪��3NaC1O![]() NaC1+NaC1O3
NaC1+NaC1O3

(1)���ռ��������30��NaOH��Һʱ�����貣����������Ͳ���_______(����ĸ)��
A������ƿ B���ձ� C����Һ�� D��������
(2)װ��A�з�����Ӧ�����ӷ���ʽ��__________����װ��C�г��ֶ�����������a�е�����Ϊ_______________��B���ñ�ˮԡ�����¶���30�����£�����ҪĿ����______________��
����2����ȡˮ���¡�
���Ʒ�Ӧ�¶ȣ�����Һ©���е���Һ��������������ƿ�У���ַ�Ӧ����������������ƿ�ڵ���Һ���ռ�108~114����֡�(��֪��N2H4��H2O+2NaC1O=N2��+3H2O+2NaC1)��
(3)��Һ©���е���Һ��___________(����A������B��)��
A��NaOH��NaC1O�����Һ B��CO(NH2)2��Һ

����3���µ����ʷ�����ⶨ��
(4)ˮ�����백ˮ�������ƣ����ڶ�Ԫ���ˮ���������ᷴӦ���������λ�ѧʽΪ_______________��
(5)ˮ���¾��л�ԭ�ԣ����������ɵ�������ȡ���0.3000g����ˮ��ɼ�20.00mL��Һ��һ����������0.1500 mol/L��I2��Һ�ζ���
��ˮ���������Һ��Ӧ�Ļ�ѧ����ʽΪ_______________________________________��
��ʵ��������I2��Һ��ƽ��ֵΪ20.00mL�������N2H4��H2O����������Ϊ__________��(������λ��Ч����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4 mol A�����2mol B������2 L���ܱ������л�ϣ�����һ�������·������·�Ӧ��2A(g)+B(g)![]() 2C(g)����Ӧ2 s����C�����ʵ���Ϊ1.2mol������˵������ȷ����
2C(g)����Ӧ2 s����C�����ʵ���Ϊ1.2mol������˵������ȷ����
A.������B��ʾ2s�ڵ�ƽ����Ӧ����Ϊ0.15 mol/(L��s)
B.������A��ʾ2 s�ڵ�ƽ����Ӧ����Ϊ0.3 mol/(L��s)
C.2 s������B��Ũ��Ϊ0.35 mol/L
D.2 s������A��ת����Ϊ30%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����������ȷ���ǣ� ��
A.��������ֻ�������ԣ��ǽ�������ֻ�л�ԭ��
B.����������Һ������뻹ԭ���۷�ֹ������������
C.��50mL��Ͳ��ȡ2mL����ˮ
D.�����Ʊ�����ʢ��ú�͵�ϸ��ƿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��Ӧʱ�����ĸ����������£����Ƹ���ˮ���ϣ����Ƴ���ˮ�ף������ۻ���С��С��Ѹ���ζ�����С�������ʧ���ݷ���˻˻�������������̪����Һ�Ժ�ɫ��������ȷ��һ����
A. �٢ۢܢݢ� B. �٢ڢۢܢ� C. �٢ڢۢ� D. ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaClO2�㷺������ֽ��ҵ����ˮ�����ȣ���Ư��������Ư�۵�4��5������ҵ����C1O2������NaClO2�Ĺ����������£�

��֪��NaClO2������Һ�ڵ���38��ʱ����NaC1O2��3H2O������38��ʱ����NaClO2
����˵������ȷ����
A. ������������NaClO2�����ӷ���ʽ��2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O
B. �����еĽᾧ�����˲���Ӧ���������ᾧ�����ȹ���
C. ����������еķ�Ӧ�¶ȿ�����߷�Ӧ���ʣ�Ҳ��߷�Ӧ���������
D. �������з�Ӧ������������ͨ��һ����������Ŀ�������ϳ�ClO2��ʹ�䱻�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йشӺ�������ȡ���ʵ��ԭ����װ���ܴﵽʵ��Ŀ�ĵ���

A. ��װ�ü������麣��
B. ��װ���ҹ��˺����ҵĽ���Һ
C. ��װ�ñ��Ʊ�������������Һ��I��Cl2
D. ��װ�ö�������������Һ��I���Cl2β��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����200mL2molL-1NaOH��Һ��ͨ���״����6.72L������̼���壬��ȫ��Ӧ��������Һ�У�
(1)��ȫ��Ӧ��������Һ������Ϊ______��
(2)��������Һ�м���0.5molL-1�����ᣬ���ټ���______mL��Ż���CO2����ų���(������CO2�ܽ���ˮ)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com