
| A�� | ԭ�Ӱ뾶��W��Z��Y��X��M | |
| B�� | YZ2����ˮ�γɵ���Һ���н�ǿ�������� | |
| C�� | 1molWM��������ˮ����ȫ��Ӧ��ת��2mol���� | |
| D�� | ��X��Y��Z��M����Ԫ���γɵĻ�����һ���������Ӽ������й��ۼ� |
���� �������������֪��X��Y��Z��M��W�����ֶ�����Ԫ�ص����У����ǰ�ԭ���������ε������еģ�����ֻ��X��Y��Z����Ԫ����ԭ���������ε�����ͬ����Ԫ�أ���X��Y��Z������������֮��Ϊ15��X��Z���γ�XZ2���ӣ�XΪ+4�ۣ�YΪ-2�ۣ����Ƴ�X��Y��Z�ֱ�ΪC��N��O����Ԫ�أ�Y��M�γɵ���̬�������ڱ�״���µ��ܶ�0.76g•L-1������̬�������Ħ������Ϊ22.4L/mol��0.76g•L-1=17g/mol����MΪHԪ�أ�W����������X��Y��Z��M����Ԫ��������֮�͵�$\frac{1}{2}$���Ƴ�W��������Ϊ$\frac{1}{2}$��6+7+8+1��=11������WΪNaԪ�أ�
��� �⣺�������������֪��X��Y��Z��M��W�����ֶ�����Ԫ�ص����У����ǰ�ԭ���������ε������еģ�����ֻ��X��Y��Z����Ԫ����ԭ���������ε�����ͬ����Ԫ�أ���X��Y��Z������������֮��Ϊ15��X��Z���γ�XZ2���ӣ�XΪ+4�ۣ�YΪ-2�ۣ����Ƴ�X��Y��Z�ֱ�ΪC��N��O����Ԫ�أ�Y��M�γɵ���̬�������ڱ�״���µ��ܶ�0.76g•L-1������̬�������Ħ������Ϊ22.4L/mol��0.76g•L-1=17g/mol����MΪHԪ�أ�W����������X��Y��Z��M����Ԫ��������֮�͵�$\frac{1}{2}$���Ƴ�W��������Ϊ$\frac{1}{2}$��6+7+8+1��=11������WΪNaԪ�أ�
A������Ԫ����Hԭ�Ӱ뾶��С��ͬ������������ԭ�Ӱ뾶��С��ͬ�������ϵ���ԭ�Ӱ뾶����ԭ�Ӱ뾶Na��C��N��O��H����W��X��Y��Z��M����A����
B��NO2����ˮ�γɵ�������Һ��������н�ǿ�������ԣ���B��ȷ��
C��NaH��ˮ������Ӧ��NaH+H2O=NaOH+H2����1molNaH��������ˮ����ȫ��Ӧ��ת��1mol���ӣ���C����
D����X��Y��Z��M����Ԫ���γɵĻ������Ϊ�������̼��李�����淋����ʣ���Ϊ�����ᣬ��ֻ���й��ۼ�����D����
��ѡ��B��
���� ���⿼��Ԫ���ƶϡ�Ԫ�������ɡ����ӽṹ��C��N��NaԪ�ػ��������ʵȣ�������ѧ���ķ��������Ŀ��飬�Ѷ��еȣ������ܶ��ж�Y��M�γɵ���̬�������ǰ���Ϊ�ƶϵĹؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���Ͳ�˿����Ҫ�ɷֶ�����ά�� | |
| B�� | ���ۺ͵�������һ�������¶��ܷ���ˮ�ⷴӦ���������� | |
| C�� | ʳ��ֲ���͵���Ҫ�ɷ��Dz�����֬��������������ڸ߷��ӻ����� | |
| D�� | �������أ�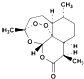 ���ϳ�˫�������أ� ���ϳ�˫�������أ�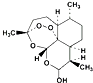 ���ķ�Ӧ���ڼӳɷ�Ӧ ���ķ�Ӧ���ڼӳɷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | �٢� | C�� | �ۢ� | D�� | �٢ڢۢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ���������� | ��Һ |
| A | ͨ��CO2����Һ����ǣ�����ͨ��CO2����������Һ����� | BaCl2��Һ |
| B | ͨ��CO2����Һ����ǣ�����ͨCO2��������������ʧ | Na2SiO3��Һ |
| C | ͨ��CO2����Һ����ǣ��ټ���Ʒ����Һ����ɫ��ȥ | Ca��ClO��2��Һ |
| D | ͨ��CO2����Һ����ǣ�����ͨCO2��������������ʧ���ټ�������NaOH��Һ�������Ա仯 | Ca��OH��2��Һ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
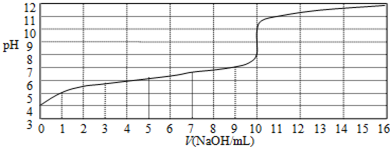
| A�� | ��ʵ�����ѡ�ü�����ָʾ�� | |
| B�� | ����HA��Ũ��ԼΪ1��10-4mol/L | |
| C�� | ��NaOH���Ϊ9 mLʱ��ǡ����ȫ�кͷ�Ӧ | |
| D�� | �ﵽ�ζ��յ�ʱ����Һ��c��Na+����c ��A-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Al��AlO2- | B�� | CO2��HCO3- | C�� | SiO2��H2SiO3 | D�� | SO2��H2SO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | N2H4��g��+2H2O2��l���TN2��g��+4H2O��l����H=+817.63 kJ•mol-1 | |
| B�� | N2H4��g��+2H2O2��l���TN2��g��+4H2O��g����H=-641.63 kJ•mol-1 | |
| C�� | N2H4��g��+2H2O2��l���TN2��g��+4H2O��l����H=-641.63 kJ•mol-1 | |
| D�� | N2H4��g��+2H2O2��l���TN2��g��+4H2O��g����H=-817.63 kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ڿ�������ʴ���������Dz����ý��� | |
| B�� | ��������ˮ��Ӧ | |
| C�� | ���ȷ�Ӧ������ұ��ijЩ�۵�ϸߵĽ��� | |
| D�� | ұ�������õ��AlCl3�ķ��� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com