
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液变浑浊,继续通入CO2至过量,溶液变澄清 | BaCl2溶液 |
| B | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失 | Na2SiO3溶液 |
| C | 通入CO2,溶液变浑浊.再加入品红溶液,红色退去 | Ca(ClO)2溶液 |
| D | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失.再加入足量NaOH溶液,无明显变化 | Ca(OH)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化碳和氯化钡溶液不能发生反应;
B.硅酸是白色不溶于酸的沉淀;
C.碳酸钙在过量二氧化碳存在下会转化为碳酸氢钙,次氯酸具有强氧化性,可使品红褪色;
D.根据氢氧化钙和碳酸钙以及碳酸氢钙的化学性质来回答.
解答 解:A.向BaCl2溶液中通入二氧化碳,不会发生反应,故A错误;
B.向Na2SiO3溶液中通入二氧化碳,会产生硅酸,Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3,硅酸是白色不溶于水的沉淀,继续通CO2至过量,浑浊不会消失,故B错误;
C.向Ca(ClO)2溶液中通入二氧化碳,会生成碳酸钙和次氯酸,碳酸钙在过量二氧化碳存在下会转化为碳酸氢钙,沉淀消失,次氯酸具有强氧化性,可使品红褪色,故C正确;
D.氢氧化钙中通二氧化碳会生成碳酸钙沉淀,再转化为碳酸氢钙,碳酸氢钙和氢氧化钠反应会生成碳酸钙,又生成白色沉淀,故D错误.
故选C.
点评 本题考查物质的鉴别和检验,题目难度中等,解答本题的关键是把握相关物质的性质,易错点为B,注意硅酸既不溶于水,也不溶于除HF酸之外的酸.


科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为-890.3 kJ•molˉ1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•molˉ1 | |
| B. | 由C(石墨,s)=C(金刚石,s)△H=+1.9 kJ•molˉ1可知,金刚石比石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OHˉ(aq)=H2O(l)△H=-57.3 kJ•molˉ1,若将含1 mol CH3COOH与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ | |
| D. | 一定条件下,某密闭容器中充入2 mol SO2(g)和1 mol O2(g),达到平衡后,放出Q kJ热量,则该条件下的热化学方程式为:2SO2(g)+O2(g)?2SO3(g )△H=-Q kJ•molˉ1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
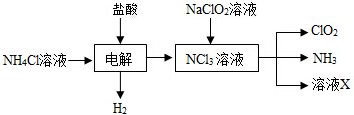
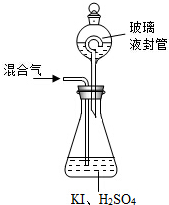
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.如表列出了待测气体及敏感电极上部分反应产物.则下列说法中正确的是( )
气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.如表列出了待测气体及敏感电极上部分反应产物.则下列说法中正确的是( )| 待测气体 | 部分电极反应产物 |
| CO | CO2 |
| H2S | H2SO4 |
| Cl2 | HCl |
| N2O4 | NO |
| A. | 上述气体检测时,敏感电极均作电池负极 | |
| B. | 检测Cl2气体时,敏感电极的电极反应式为Cl2+2e-═2Cl- | |
| C. | 检测H2S气体时,对电极充入空气,对电极上的电极反应式为O2+4e-═2O2- | |
| D. | 检测H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某密闭容器盛有0.2molSO2和0.1molO2,在一定条件下充分反应,转移电子的数目为0.4NA | |
| B. | 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为NA | |
| C. | 1L0.1mol/LCuCl2溶液中含有Cu2+离子数小于0.1NA | |
| D. | 1mol/L醋酸溶液中含有的H+离子数小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同种物质 | B. | 不同密度的核素 | ||
| C. | 同位素 | D. | 相同元素构成的不同单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X>M | |
| B. | YZ2溶于水形成的溶液具有较强的氧化性 | |
| C. | 1molWM溶于足量水中完全反应共转移2mol电子 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
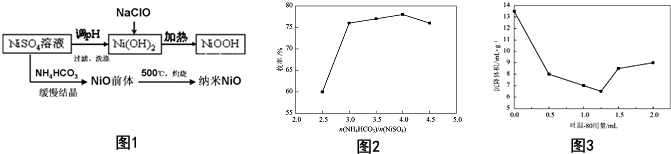
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸氢钠 | B. | 明矾 | C. | 碳酸氢钠 | D. | 醋酸钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com