
| A. | ①②④ | B. | ①⑤ | C. | ③④ | D. | ①②③④⑤ |
分析 Na与氯气反应生成氯化钠,根据固体增重,可知增重为氯元素的质量,根据n=$\frac{m}{M}$计算氯原子的物质的量,根据化学式可得n(Na)=n(Cl),钠与氧气反应,全部生成Na2O时,固体的质量最小,全部生成Na2O2时,固体的质量最大,根据化学式中钠原子与氧原子的比例关系计算与氧气反应固体增重,据此解答.
解答 解:mg Na在足量氯气中燃烧,生成NaCl的质量为(m+3.55g),
则m(Cl)=3.55g,故n(Cl)=$\frac{3.55g}{35.5g/mol}$=0.1mol,
根据NaCl化学式可得n(Na)=n(Cl)=0.1mol,
钠与氧气反应,全部生成Na2O时,固体的质量最小,固体增重为氧原子质量,增重为$\frac{0.1mol}{2}$×16g/mol=0.8g,所以固体的质量为(m+0.8)g,
全部生成Na2O2时,固体的质量最大,固体增重为氧原子质量,增重为0.1mol×16g/mol=1.6g,所以固体的质量为(m+1.6)g,
故钠与氧气反应生成固体的质量:(m+0.8)g≤m(固体)≤(m+1.6)g,
故选D.
点评 本题考查有关化学计算,难度中等,利用极值法确定固体质量的极大值与极小值是关键.


科目:高中化学 来源: 题型:选择题
| A. | HClO>Cl2>Fe3+>Cu2+>Fe2+ | B. | Cl2>HClO>Fe3+>Cu2+>Fe2+ | ||
| C. | Cl2>Fe3+>HClO>Cu2+>Fe2+ | D. | HClO>Cl2>Cu2+>Fe3+>Fe2+. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
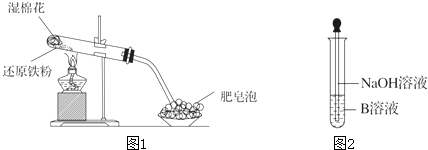
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
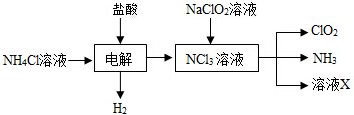
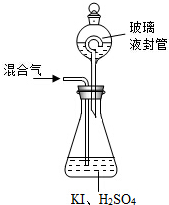
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁有良好的导热性,常用来制作炊具 | |
| B. | 铜的化学性质不活泼,因此可用于制导线 | |
| C. | 废旧电池中汞的回收可减少对环境的污染 | |
| D. | 钛合金与人体有很好的“相容性,因此可用来制造人造骨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.如表列出了待测气体及敏感电极上部分反应产物.则下列说法中正确的是( )
气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.如表列出了待测气体及敏感电极上部分反应产物.则下列说法中正确的是( )| 待测气体 | 部分电极反应产物 |
| CO | CO2 |
| H2S | H2SO4 |
| Cl2 | HCl |
| N2O4 | NO |
| A. | 上述气体检测时,敏感电极均作电池负极 | |
| B. | 检测Cl2气体时,敏感电极的电极反应式为Cl2+2e-═2Cl- | |
| C. | 检测H2S气体时,对电极充入空气,对电极上的电极反应式为O2+4e-═2O2- | |
| D. | 检测H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某密闭容器盛有0.2molSO2和0.1molO2,在一定条件下充分反应,转移电子的数目为0.4NA | |
| B. | 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为NA | |
| C. | 1L0.1mol/LCuCl2溶液中含有Cu2+离子数小于0.1NA | |
| D. | 1mol/L醋酸溶液中含有的H+离子数小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X>M | |
| B. | YZ2溶于水形成的溶液具有较强的氧化性 | |
| C. | 1molWM溶于足量水中完全反应共转移2mol电子 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com