
| A. | NH4+ | B. | NH2- | C. | NH3 | D. | Na+ |
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:解答题
 (1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在实际中可以设计成原电池的是C
(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在实际中可以设计成原电池的是C查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶用蒸馏水洗净后需晾干才能使用 | |
| B. | 需称取NaC1O固体144g | |
| C. | 所配得NaC1O消毒液久置后会失效 | |
| D. | 8 4消毒液的消毒原理是利用了NaClO的强碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
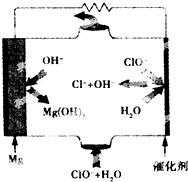 镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )
镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )| A. | 该燃料电池中镁为负极,发生氧化反应 | |
| B. | 正极反应式为ClO-+H2O+2e-═Cl-+2OH- | |
| C. | 电池总反应式为Mg+ClO-+H2O═Mg(OH)2↓+Cl- | |
| D. | 放电过程中OH-移向正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4+2NaOH═Na2SO4+2H2O | B. | NH3+HCl═NH4Cl | ||
| C. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | D. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 剩余固体 | 剩余固体的物质的量之比 |
| A | Pb3O4,PbO | 1:1 |
| B | PbO2,Pb3O4 | 1:1 |
| C | PbO2,Pb3O4,PbO | 1:2:1 |
| D | PbO2,Pb3O4,PbO | 1:1:2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com