
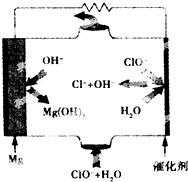
 镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )
镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )| A. | 该燃料电池中镁为负极,发生氧化反应 | |
| B. | 正极反应式为ClO-+H2O+2e-═Cl-+2OH- | |
| C. | 电池总反应式为Mg+ClO-+H2O═Mg(OH)2↓+Cl- | |
| D. | 放电过程中OH-移向正极 |
分析 该燃料电池中,镁易失电子作负极、次氯酸根离子得电子发生还原反应,负极电极反应式为Mg-2e-=Mg 2+,正极电极反应式为:ClO-+H2O+2e-=Cl-+2OH-,放电时,电解质溶液中阴离子向负极移动.
解答 解:A.镁失电子发生氧化反应而作负极,故A正确;
B.正极上双氧水得电子发生还原反应,电极反应式为ClO-+H2O+2e-═Cl-+2OH-,故B正确;
C.镁在负极上失电子生成镁离子,次氯酸根离子在正极上得电子和水生成氯离子和氢氧根离子,所以电池反应式为:Mg+ClO-+H2O=Mg(OH)2+Cl-,故C正确;
D.放电过程中氢氧根离子向负极移动,故D错误;
故选D.
点评 本题考查了原电池原理,明确正负极上发生的反应是解本题关键,再结合离子移动方向来分析解答,题目难度不大.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
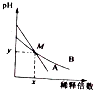 室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示,下列说法正确的是( )
室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示,下列说法正确的是( )| A. | 稀释前,c(A)=10c(B) | |
| B. | 在M点,A、B两种碱溶液中阳离子的物质的量浓度相等 | |
| C. | 稀释前,A溶液中由水电离出的OH-的浓度大于10-7mol/L | |
| D. | 由图可知,A为强碱,B为弱碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用高效低毒的农药,既能提高作物产量,又能降低农药残留量 | |
| B. | 食品包装袋中常放入生石灰作为抗氧化剂,防止食品变质 | |
| C. | 水瓶胆中的水垢可用饱和食盐水清洗 | |
| D. | 明矾可用于净水,也可用于淡化海水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做金属钠与水反应实验时,剩余的钠不能再放入原试剂瓶 | |
| B. | 酸式滴定管装标准液前,必须先用该溶液润洗 | |
| C. | 锥形瓶用作反应容器时一定不能加热 | |
| D. | 用容量瓶配溶液时,若加水超过刻度线,立即用滴定管吸出多余液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加100mL水将溶液稀释 | |
| B. | 向溶液中加入0.2molNaOH固体,并使之完全溶解 | |
| C. | 将溶剂蒸发掉一半 | |
| D. | 将原溶液浓缩至50mL(无NaOH析出) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHC03水溶液显碱性,溶液中阳离子电荷总数小于阴离子电荷总数 | |
| B. | SiO2不跟碱反应,但可与氢氟酸反应 | |
| C. | NO2难液化,易溶于水并跟水反应 | |
| D. | Fe3O4能与浓盐酸反应生成FeCl2和FeCl3 |
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三月考二化学试卷(解析版) 题型:实验题
高铁酸钾广泛应用于净水、电池工业等领域。工业上以钛白粉生产的副产品FeSO4制备高铁酸钾的生产流程如下:

查资料得知K2FeO4的一些性质:
①在碱性环境中稳定,在中性和酸性条件下不稳定。
②在水中溶解度很大,难溶于无水乙醇等有机溶剂。
回答下列问题:
(1)写出氧化I中,生成Fe3+的离子反应方程式:
(2)氧化II中,试剂A为 (填“H2O2”或“HNO3”或“NaC1O”),反应的离子方程式为_____________________。
(3)操作I中包括冷却结晶,过滤洗涤、干燥几个步骤,洗涤干燥的目的是脱碱脱水,进行洗涤操作时应该用 洗涤。
(4)净水时高铁酸钾能逐渐与水反应生成絮状的Fe(OH)3,请补充并配平该反应方程式的系数及产物:
______K2FeO4 + H2O  Fe(OH)3(胶体)+ KOH + 。
Fe(OH)3(胶体)+ KOH + 。
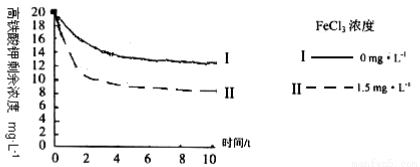
将一定量的K2FeO4投入一定浓度的FeC13溶液中,测得剩余K2FeO4浓度如下图所示,推测产生曲线I和曲线II差异的原因是: 。
(5)制得的粗K2FeO4产品中常混有少量KCl。取5.0 g粗产品溶于足量稀硝酸,充分反应后,加入足量的硝酸银,过滤得到沉淀,洗涤、干燥,称量得到1.435 g固体,K2FeO4的质量分数为___________。(可能用到的相对原子质量:O 16 Cl 35.5 K 39 Fe 56 Ag 108)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com