
【题目】由下列元素形成的单质,不能实现如下转化关系的是:
单质![]() 氧化物
氧化物![]() 酸(或碱)
酸(或碱)![]() 盐
盐
A. CB. SC. NaD. Al
科目:高中化学 来源: 题型:
【题目】CO2和CH4均为温室气体,若得以综合利用,对温室气体整治具有重大意义。
(1)已知:
CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) △H=+247.3kJ·mol-1
2CO(g)+2H2(g) △H=+247.3kJ·mol-1
CH4(g)![]() C(s)+2H2(g) △H=+75.0kJ·mol-1
C(s)+2H2(g) △H=+75.0kJ·mol-1
反应2CO(g)![]() C(s)+CO2(g)在_______能自发进行。
C(s)+CO2(g)在_______能自发进行。
A、高温 B、低温 C、任意温度 D、任意温度都不能
(2)合成甲醇的主要反应是CO(g)+2H2(g)![]() CH3OH(g)。初始压强P1下,向体积为2L的恒容密闭容器中充入b mol CO和2b mol H2,平衡时CO的转化率与温度、压强的关系如图所示。请回答:
CH3OH(g)。初始压强P1下,向体积为2L的恒容密闭容器中充入b mol CO和2b mol H2,平衡时CO的转化率与温度、压强的关系如图所示。请回答:
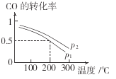
①下列判断正确的是______
A、放热反应 P1>P2 B、放热反应 P1<P2
C、吸热反应 P1>P2 D、吸热反应 P1<P2
②200℃时,该反应的平衡常数K=_______(用含b的代数式表示)。若上述反应经过tmin达到平衡,则该时间段内氢气的平均反应速率为_______。
(3)实验室可用Na2CO3 与盐酸混合制备少量CO2。在25℃时,取10.6g Na2CO3 与盐酸混合所得的一组体积为1L 的溶液,溶液中部分微粒与pH 的关系如图所示。则:
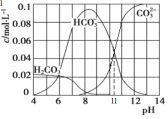
①根据图中数据,计算CO32-的水解常数K=____________________。
②pH = 6的溶液中:c(H2CO3)+ c(HCO3-)+ c(CO32-)_____(填>、<或=)0.1 mol·L-1
(4)以甲烷为燃料的酸性燃料电池负极反应式:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 时
时
化学式 |
|
|
|
电离平衡常数 |
|
|
|
下列说法正确的是 ( )
A. 醋酸稀释过程中,![]() 逐渐减小
逐渐减小
B. ![]() 溶液中:
溶液中:![]()
C. 向醋酸或HCN溶液中加入![]() ,均产生
,均产生![]()
D. 物质的量浓度相同时![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究金属钠与水或盐酸的反应记录如下。
实验序号 | 实验内容 | 实验现象 |
I | 0.23g钠与20mL蒸馏水 | 钠浮在水面上,熔成小球四处游动,发出嘶嘶响声,20s后钠块消失 |
II | 0.23g纳与20ml | 钠浮在水面上,熔成小球四处游动,发出嘶嘶响声,13s后钠块消失 |
(1)由实验现象可推断:金属钠与水成盐酸的反应,反应的共同特征是__________(写出两点)。
(2)研究实验I
①实验前水中![]() ______________。
______________。
②实验结束后所得溶液显碱性,原因可能是____________(填序号)。
a.生成的氢氧化钠属于碱
b.氢氧化钠在水中能电离出![]()
c.氢氧化钠抑制了水的电离,导致由水电离产生的![]()
d.钠与![]() 反应,促进水的电离,导致
反应,促进水的电离,导致![]()
(3)研究实验II
①实验前溶液pH=_____________
②实验结束后,溶液中离子浓度由大到小的顺序是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从含有CuCl2、FeCl2、FeCl3的工业废液中回收铜并制备氯化铁晶体的流程如下:
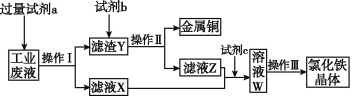
则下列说法正确的是
A. 试剂a是铁,试剂b是稀硫酸
B. 操作Ⅰ、操作Ⅱ、操作Ⅲ所用的仪器完全相同
C. 试剂c是氯气,反应的离子方程式为2Fe2++Cl2![]() 2Fe3++2Cl-
2Fe3++2Cl-
D. 用KSCN溶液可检验溶液W中是否有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将标准状况下6.72L HCl溶于水配成100mL溶液,现用此盐酸与19.5g 锌粒反应制取氢气。试计算:(写出计算过程)
(1)此盐酸的物质的量浓度________________
(2)若要使锌完全反应,则所需盐酸的最小体积______________
(3)当锌粒完全反应时,制得标准状况下氢气的体积___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断:

(1)写出A、B、C、D、E、F的化学式:
A._______;B.______;C.______;
D._______;E.______;F._______。
(2)写出有关反应的化学方程式(是离子反应的直接写出离子方程式)
E![]() B:______
B:______
C![]() F:______
F:______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种烃分子中均含有8个氢原子,其中A、B常温下呈气态,C、D、E呈液态。请回答
(1)A是符合上述条件中相对分子质量最小的,则A的分子式为________;B属于链状单烯烃,且与HBr加成的产物只有一种,试写出B的结构简式________。
(2)C属于芳香烃,可用来制烈性炸药,试写出C制取烈性炸药的方程式_______________________________。
(3)已知E的结构简式为![]() 存在于煤焦油中,所有原子均处于同一平面内,则1mol E 最多能和___ mol的H2加成,写出E的所有一氯代物的结构简式_____________________________。
存在于煤焦油中,所有原子均处于同一平面内,则1mol E 最多能和___ mol的H2加成,写出E的所有一氯代物的结构简式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列说法正确的是( )
A. 常温常压下,31g P4(结构式: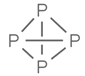 )中所含P-P键数目为1.5NA
)中所含P-P键数目为1.5NA
B. 1L 0.1mol/L硫酸钠溶液中含有的氧原子数为0.4NA
C. 1mol重水与1mol水中,中子数比为2∶1
D. 密闭容器中,2molSO2和1molO2催化反应后分子总数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com