
【题目】有甲、乙两种物质:
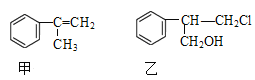
(1)乙中含有的官能团的名称为____________________(不包括苯环)。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
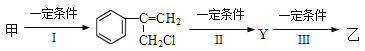
其中反应I的反应类型是___________,反应II的条件是_______________,反应III的化学方程式为_______________________(不需注明反应条件)。
(3)下列物质不能与乙反应的是_________(选填序号)。
a.金属钠 b.氢氧化钠的乙醇溶液 c.碳酸钠溶液 d.乙酸
(4)乙有多种同分异构体,任写其中一种能同时满足下列条件的同分异构体结构简式____________。
a.苯环上的一氯代物有两种 b.遇FeCl3溶液显示紫色
【答案】氯原子、羟基 取代反应 NaOH溶液、加热 ![]() c
c ![]() 、
、![]() 、
、![]() 、、
、、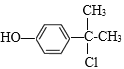 、
、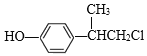 中任意一种
中任意一种
【解析】
(1)决定有机物化学特性的原子或原子团叫官能团,根据物质结构简式,判断官能团;
(2)对比物质甲与反应生成的![]() 的结构的不同,判断反应类型,利用
的结构的不同,判断反应类型,利用![]() 与物质乙的区别,结合卤代烃、烯烃的性质通过II、III反应转化为物质乙;
与物质乙的区别,结合卤代烃、烯烃的性质通过II、III反应转化为物质乙;
(3)乙的官能团是-OH、—Cl,-OH可以与Na发生置换反应、与羧酸发生酯化反应,—Cl原子可以发生水解反应、若与Cl原子连接的C原子的邻位C原子上有H原子,则可以发生消去反应;
(4)同分异构体是分子式相同,结构不同的化合物的互称,结合对同分异构体的要求进行书写。
(1)![]() 含有的官能团有氯原子、羟基;
含有的官能团有氯原子、羟基;
(2)![]() 在一定条件下发生甲基上的取代反应生成
在一定条件下发生甲基上的取代反应生成![]() ,
,![]() 再与NaOH的水溶液在加热条件下发生取代反应生成
再与NaOH的水溶液在加热条件下发生取代反应生成![]() ,
,![]() 与HCl在一定条件下发生加成反应生成物质乙
与HCl在一定条件下发生加成反应生成物质乙![]() 。所以反应I的反应类型是取代反应,反应II的条件是NaOH水溶液、加热,反应III的化学方程式为
。所以反应I的反应类型是取代反应,反应II的条件是NaOH水溶液、加热,反应III的化学方程式为![]() ;
;
(3) a.乙中含醇-OH,可以与金属钠发生置换反应生成氢气,a不符合题意;
b.乙中含有氯原子,由于与Cl原子连接的C原子的邻位C原子上有H原子,所以可以与氢氧化钠的乙醇溶液发生消去反应生成![]() ,b不符合题意;
,b不符合题意;
c.乙中含有的官能团都不能与碳酸钠溶液反应,c符合题意;
d.乙中含有醇羟基,可以与乙酸在一定条件下发生酯化反应,d不符合题意;
故合理选项是c;
(4)化合物乙结构简式为![]() ,乙的同分异构体要求符合:a.苯环上的一氯代物有两种,说明苯环有2个处于对位的取代基;b.遇FeCl3溶液显示紫色,说明有酚羟基,则符合题意的同分异构体结构简式为
,乙的同分异构体要求符合:a.苯环上的一氯代物有两种,说明苯环有2个处于对位的取代基;b.遇FeCl3溶液显示紫色,说明有酚羟基,则符合题意的同分异构体结构简式为![]() 、
、![]() 、
、![]() 、、
、、 、
、 。
。


科目:高中化学 来源: 题型:
【题目】在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体d呈喷泉状喷出,最终几乎充满烧瓶,则a和b分别是( )
选项 | a(干燥气体) | b(液体) |
|
A | NO2 | 水 | |
B | CO2 | 饱和NaHCO3溶液 | |
C | Cl2 | 饱和NaCl溶液 | |
D | NH3 | 1 mol·L-1盐酸 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯乙酸(CCl3COOH)是饮用水中常见污染物,难以直接氧化降解。通过Fe/Cu微电池法和芬顿法可将三氯乙酸除去。
(1)pH=4时,向含有三氯乙酸的水样中投入铁屑和铜屑,通过原电池反应生成的活性氢原子(H)将CCl3COOH脱氯后转化为CHCl2COOH。
①原电池反应时的负极反应式为___。
②写出活性氢原子(H)与CCl3COOH反应的离子方程式:___。
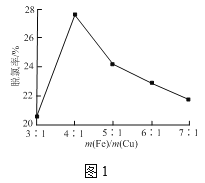
③铁屑和铜屑的总质量一定,改变铁屑和铜屑的质量比,水样中单位时间三氯乙酸的脱氯率如图1所示,当m(Fe)/m(Cu)大于4时,铁屑质量越大,脱氯率越低的原因是___。
(2)取上述反应后的溶液,向其中加入H2O2,发生图2所示转化,生成羟基自由基(·OH),·OH能将溶液中的CHCl2COOH等物质进一步脱氯除去。
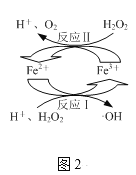
①图2所示转化中化合价未发生变化的元素是___。
②写出图2所示转化中反应Ⅱ的离子方程式:___。
③控制水样的pH不同,所得脱氯率如图3所示,当pH>4后,脱氯率逐渐下降的原因是___。

④加入H2O2后需控制溶液的温度,温度过高时脱氯率减小的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大, X、Z、W 均可形成酸性氧化物。X的一种氢化物分子空间构型为三角锥型,YW是氯碱工业的主要原料,Z的最外层电子数为4,请回答以下问题:
(1)表示氯碱工业生产原理的化学方程式为____________________________________。
(2)X的另一种氢化物X2H4可作为火箭推进器燃料,其结构式为__________________ 。
(3)Y的氧化物中,有一种既含离子键又含共价键,该氧化物的电子式为 ___________。
(4)Z的氧化物属于晶体,工业制备Z单质的化学方程式为________________________。
(5)W单质是毒性很大的窒息性气体。工业上用X气态氢化物的浓溶液检验W单质是否泄露,写出反应的化学方程式_________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某种兴奋剂的结构简式如图所示。有关该物质的说法中正确的是 ( )

A. 该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
B. 能使酸性KMnO4溶液褪色,证明其结构中存在碳碳双键
C. 1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为10mol和7mol
D. 该分子中的所有碳原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的化学资源宝库,利用海水可以获取很多物质。海水中主要离子有Na+、K+、Ca2+、Mg2+、Cl-、SO42-等。
利用1:淡水工业
(1)海水淡化的方法主要有__、电渗析法、离子交换法等。
(2)电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示。
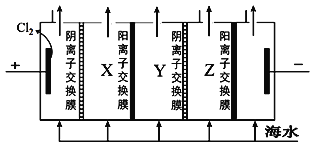
①淡水在__室(填X、Y或Z)形成后流出。
②一般海水不直接通入到阴极室中,原因是______________。
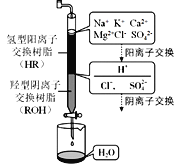
(3)离子交换法净化海水模拟过程如图所示,氢型阳离子交换原理可表示为:HR+Na+=NaR+H+,……。羟型阴离子交换树脂填充段存在的反应有______________。
利用2:提溴工业
(4)用海水晒盐之后的盐卤可提取溴,提取流程如图:

①用热空气将溴赶出,在吸收塔先用浓Na2CO3溶液吸收Br2,Br2歧化为Br-和BrO3-,再加入W溶液得到Br2。推测W是______________。
②蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是____________。
③将1m3海水浓缩至1L,使用该法最终得到38.4gBr2,若总提取率为60%,则原海水中溴的浓度是__mg/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 都属于多环烃类,下列有关它们的说法错误的是
都属于多环烃类,下列有关它们的说法错误的是
A. 这三种有机物的二氯代物同分异构体数目相同
B. 盘烯能使酸性高锰酸钾溶液褪色
C. 棱晶烷和盘烯互为同分异构体
D. 等质量的这三种有机物完全燃烧,耗氧量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A. (CH3)2C=CH2的名称为2-甲基-1-丁烯
B. 丙烷的二氯代物有4种同分异构体
C. 苯分子的碳碳双键可与氢气发生加成反应
D. CH3-CH=CH-C![]() C-CH3分子中所有碳原子不可能在同一平面上
C-CH3分子中所有碳原子不可能在同一平面上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com