
【题目】三氯乙酸(CCl3COOH)是饮用水中常见污染物,难以直接氧化降解。通过Fe/Cu微电池法和芬顿法可将三氯乙酸除去。
(1)pH=4时,向含有三氯乙酸的水样中投入铁屑和铜屑,通过原电池反应生成的活性氢原子(H)将CCl3COOH脱氯后转化为CHCl2COOH。
①原电池反应时的负极反应式为___。
②写出活性氢原子(H)与CCl3COOH反应的离子方程式:___。
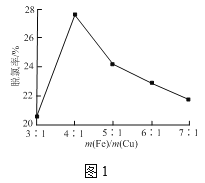
③铁屑和铜屑的总质量一定,改变铁屑和铜屑的质量比,水样中单位时间三氯乙酸的脱氯率如图1所示,当m(Fe)/m(Cu)大于4时,铁屑质量越大,脱氯率越低的原因是___。
(2)取上述反应后的溶液,向其中加入H2O2,发生图2所示转化,生成羟基自由基(·OH),·OH能将溶液中的CHCl2COOH等物质进一步脱氯除去。
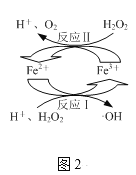
①图2所示转化中化合价未发生变化的元素是___。
②写出图2所示转化中反应Ⅱ的离子方程式:___。
③控制水样的pH不同,所得脱氯率如图3所示,当pH>4后,脱氯率逐渐下降的原因是___。

④加入H2O2后需控制溶液的温度,温度过高时脱氯率减小的原因是___。
【答案】Fe-2e-=Fe2+ CCl3COOH+2H=CHCl2COOH+Cl-+H+ 形成Fe/Cu微电池的数目减少 H 2Fe3++H2O2=2Fe2++2H++O2↑ Fe2+、Fe3+发生水解,浓度降低,减少了·OH的生成 H2O2发生分解
【解析】
(1)①含有三氯乙酸的水样中投入铁屑和铜屑,酸性环境,组成铜锌原电池,铁作负极,负极反应式为Fe-2e-=Fe2+;
②原电池反应生成的活性氢原子(H)将CCl3COOH脱氯后转化为CHCl2COOH,活性氢原子(H)与CCl3COOH反应的离子方程式:CCl3COOH+2H=CHCl2COOH+Cl-+H+;
③铁屑和铜屑的总质量一定,改变铁屑和铜屑的质量比,当m(Fe)/m(Cu)大于4时,铁屑质量越大,形成的Fe/Cu微电池数目越少,生成的活性氢速率越低,单位时间内脱氯率越低;
(2)①上述反应后的溶液有Fe2+,向其中加入H2O2,发生图2所示转化Fe2+转化为Fe3+,H2O2转化为羟基自由基(·OH),故铁元素和氧元素化合价发生变化,氢元素化合价未发生变化;
②根据图2所示转化中,反应Ⅱ中H2O2转化为O2,Fe3+转化为Fe2+,故反应Ⅱ的离子方程式:2Fe3++H2O2=2Fe2++2H++O2↑;
③酸性条件会抑制Fe3+和Fe2+的水解,随着pH增大,Fe3+和Fe2+的水解程度增大,减小了羟基自由基的生成,因此根据脱氯率图3所示,当pH>4后,脱氯率逐渐下降的原因是Fe2+、Fe3+发生水解,浓度降低,减少了·OH的生成;
④由于双氧水溶液受热易分解,生成羟基自由基(·OH)减少,脱氯率减小,因此需控制溶液的温度,温度过高时脱氯率减小的原因是H2O2发生分解。


科目:高中化学 来源: 题型:
【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号 | I | II | III |
实验步骤 |
充分振荡,加2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去, 变成蓝色,加入蒸馏水后无白色沉淀 |
下列说法不正确的是( )
A.实验I、II、III中均发生了反应2Fe3++Cu=2Fe2++Cu2+
B.对比实验I、II、III说明白色沉淀的产生可能与铜粉的量及溶液的阴离子种类有关
C.实验I、III中加入蒸馏水后c(Cu2+)相同
D.向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以饱和食盐水、NH3和CO2为原料,可以制取纯碱。下列说法正确的是( )
A.由反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0可知反应物所含键能总和大于生成物所含键能总和
2NH3(g) ΔH<0可知反应物所含键能总和大于生成物所含键能总和
B.常温常压下,电解饱和食盐水时,每生成2.24LCl2,电路中转移0.2mol电子
C.室温下,稀释纯碱溶液时,溶液的pH减小
D.反应Na2O(s)+CO2(g)=Na2CO3(s)常温下可自发进行,该反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,利用培养皿探究SO2的性质。实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面皿扣在上面。
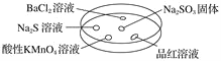
下表中对实验现象的描述或所做的解释不正确的是( )
选项 | 实验现象 | 解释 |
A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
C | 酸性KMnO4溶液褪色 | SO2具有还原性 |
D | 品红溶液褪色 | SO2具有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种治疗失眠症的药物,其一种合成路线如图:
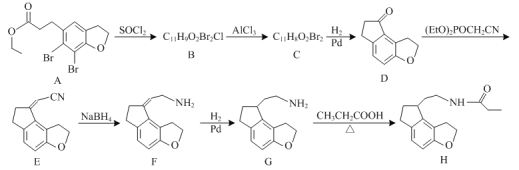
已知:![]()
(1)化合物G中所含官能团的名称为___和___。
(2)G→H的化学反应类型为___反应。
(3)化合物B的结构简式为___。
(4)E的一种同分异构体满足下列条件,写出该同分异构体的结构简式:___。
①含有萘环(![]() );
);
②能发生水解反应,水解所得两种产物中碳原子数之比为3∶10。
(5)写出以![]() 和(EtO)2POCH2CN为原料制备
和(EtO)2POCH2CN为原料制备![]() 的合成路线流程图(无机试剂和有机溶剂任用,合成路线例见本题题干)___。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线例见本题题干)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脲醛树脂的合成与酚醛树脂类似,生成线型脲甲醛树脂的方程式为:n![]() +nHCHO
+nHCHO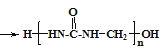 +xH2O,下列说法不正确的是( )
+xH2O,下列说法不正确的是( )
A.网状的脲甲醛树脂以如图所示结构单元为主
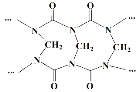
B.方程式中的化学计量数x=n-1
C.脲甲醛树脂合成过程中可能存在中间体![]()
D.通过质谱法测定线型脲甲醛树脂的平均相对分子质量,可得其聚合度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2与Cl2的氧化性相近。在自来水消毒和果蔬保鲜等方面应用广泛。
Ⅰ.实验室制备Cl2的离子方程式____________________________。
Ⅱ.某兴趣小组通过下图装置(夹持装置略)ClO2对制备、吸收、释放和应用进行了研究。
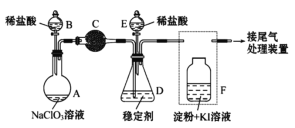
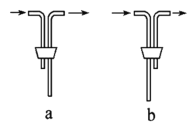
(1)仪器B的名称是___________。安装F中导管时,应选用上图中的_________。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。为使ClO2 在D中被稳定剂充分吸收,滴加稀盐酸的速度宜___________ (填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是___________ 。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为__________________,装置F中的现象是________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两种物质:
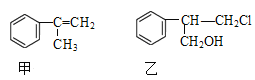
(1)乙中含有的官能团的名称为____________________(不包括苯环)。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
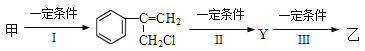
其中反应I的反应类型是___________,反应II的条件是_______________,反应III的化学方程式为_______________________(不需注明反应条件)。
(3)下列物质不能与乙反应的是_________(选填序号)。
a.金属钠 b.氢氧化钠的乙醇溶液 c.碳酸钠溶液 d.乙酸
(4)乙有多种同分异构体,任写其中一种能同时满足下列条件的同分异构体结构简式____________。
a.苯环上的一氯代物有两种 b.遇FeCl3溶液显示紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷及其化合物被运用在农药、除草剂、杀虫剂与多种合金中,其中三氧化二砷(AS2O3)被称为砒霜,是一 种毒性很强的物质。回答下列问题:
(1)As在元素周期表中的位置是_____________,AsH3的电子式_________。
(2)一定条件下,雄黄(As4S4)与As2O3的转化关系如图所示。若该反应中1mol As4S4(其中As元素的化合价为+2)参加反应时,转移28mole-,则物质a为_________(填化学式)。

(3)焦炭真空冶炼砷时需加入催化剂,其中部分反应的热化学方程式如下:
反应 I .As2O3(g) +3C(s) ![]() 2As(g) +3CO(g)
2As(g) +3CO(g) ![]() =a kJ· mol-1
=a kJ· mol-1
反应 II.As2O3(g) +3C(s) ![]()
![]() As4(g) +3CO(g)
As4(g) +3CO(g) ![]() =b kJ ·mol-1
=b kJ ·mol-1
反应III.As4(g) ![]() 4As(g)
4As(g) ![]()
① ![]() =_________kJ ·mol-1 (用含a,b的代数式表示)。
=_________kJ ·mol-1 (用含a,b的代数式表示)。
②反应中催化剂的活性会因为反应II[生成As4(g)]的发生而降低,同时存在的反应III可使As4(g)的量减少。已知催化剂X、Y的相关数据如表所示:
反应II | 反应III | ||
活化能/ (kJ ·mol -1 ) | 催化剂X | 56 | 75 |
催化剂Y | 37 | 97 | |
由表中数据判断催化剂X_______ (填“优于”或“劣于”)催化剂Y。
(4)298 K 时,将 20mL 3xmol·L-1 Na3AsO3溶液、20 ml 3xmol·L-l I2溶液和 20mL 6xmol· L-l NaOH 溶液混合(忽略溶液体积变化),发生反应:![]() (aq) +I2(aq) +2OH-(aq)
(aq) +I2(aq) +2OH-(aq)![]()
![]() (aq) +2I-(aq) +H2O(l)。溶液中 c(
(aq) +2I-(aq) +H2O(l)。溶液中 c(![]() )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
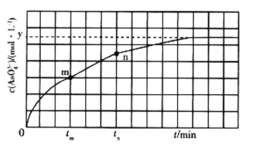
①下列可说明反应达到平衡的是_______ (填标号)。
a.v(I- ) =2v(![]() )
)
b.溶液的c(OH-)不再发生变化
c.c(I-) =ymol· L-1
d.c(![]() )/c(
)/c(![]() )不再发生变化
)不再发生变化
e.c(Na+) =5xmol· L-1
②tm min时,v正(![]() )_______ (填“大于”“小于”或“等于”)v逆(
)_______ (填“大于”“小于”或“等于”)v逆( ![]() )。
)。
③tm min时v逆( ![]() ) _______ (填“大于”“小于”或“等于”)tn时v逆(
) _______ (填“大于”“小于”或“等于”)tn时v逆( ![]() ),理由是___________________。
),理由是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com