
【题目】ClO2与Cl2的氧化性相近。在自来水消毒和果蔬保鲜等方面应用广泛。
Ⅰ.实验室制备Cl2的离子方程式____________________________。
Ⅱ.某兴趣小组通过下图装置(夹持装置略)ClO2对制备、吸收、释放和应用进行了研究。
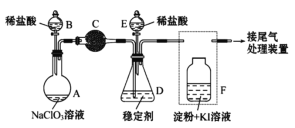
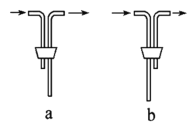
(1)仪器B的名称是___________。安装F中导管时,应选用上图中的_________。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。为使ClO2 在D中被稳定剂充分吸收,滴加稀盐酸的速度宜___________ (填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是___________ 。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为__________________,装置F中的现象是________________ 。
【答案】MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑ 分液漏斗 b 慢 吸收Cl2 4H++5ClO2-=Cl-+4ClO2↑+2H2O 淀粉碘化钾溶液变蓝
Mn2++2H2O+Cl2↑ 分液漏斗 b 慢 吸收Cl2 4H++5ClO2-=Cl-+4ClO2↑+2H2O 淀粉碘化钾溶液变蓝
【解析】
二氧化锰与浓盐酸在加热的条件下反应生成氯化锰、氯气和水。装置A中盛放NaClO3溶液,装置B盛放稀盐酸,两者混合发生反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O,装置C的作用是吸收Cl2,除去氯气,ClO2在装置D中被稳定剂完全吸收生成NaClO2,在酸性条件下NaClO2可发生反应4H++5ClO2-=Cl-+4ClO2↑+2H2O生成NaCl并释放出ClO2,装置F检验二氧化氯中氯气是否完全被装置C吸收,据此分析。
Ⅰ.二氧化锰与浓盐酸在加热的条件下反应生成氯化锰、氯气和水,实验室制备Cl2的离子方程式为:MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑;
Mn2++2H2O+Cl2↑;
Ⅱ.(1)根据仪器的形状可知,仪器B的名称是分液漏斗;根据操作分析,F装置应是氯气和KI 反应,所以应长管进气,短管出气,选b;
(2)为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度要慢;
(3)F装置中发生反应Cl2+2KI=2KCl+I2,碘遇淀粉变蓝,所以F中溶液的颜色不变,则装置C的作用是吸收Cl2;
(4)在酸性条件下,NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为 4H++5ClO2-=Cl-+4ClO2↑+2H2O;二氧化氯是一种强氧化剂,与碘化钾反应将生成碘、氯化钾和盐酸,淀粉溶液遇到碘会变成蓝色,实验现象是溶液变成蓝色。


科目:高中化学 来源: 题型:
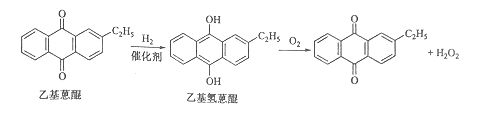
【题目】双氧水是一种重要的氧化剂、漂白剂和消毒剂。生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:
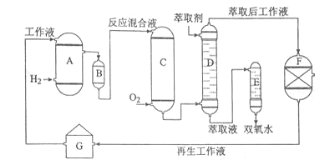
A.氢化釜 B.过滤器 C.氧化塔 D.萃取塔 E..净化塔 F.工作液再生装置 G.工作液配制装置
生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定的温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水。回答下列问题:
(1)蒽醌法制备双氧水理论上消耗的原料是_______,循环使用的原料是______,配制工作液时采用有机溶剂而不采用水的原因是______。
(2)氢化釜A中反应的化学方程式为_______,进入氧化塔C的反应混合液中的主要溶质为_______。
(3)萃取塔D中的萃取剂是____,选择其作萃取剂的原因是______。
(4)工作液再生装置F中要除净残留的H2O2,原因是______。
(5)双氧水浓度可在酸性条件下用KMnO4溶液测定,该反应的离子方程式为_______。一种双氧水的质量分数为27.5%,(密度为1.10g·cm3),其浓度为______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:① X、Y、Z、W、R、Q为原子序数依次增大的短周期元素。X 是所有元素中原子半径最小的元素,Y是形成化合物种类最多的元素,W的最外层电子数是次外层电子数的3倍,Q与W同主族,Y、R原子的最外层电子数之和等于Z的最外层电子数。
②莱纳斯·卡尔·鲍林在1932年提出electronegativity作为元素原子在化合物某种性质的标度,electronegativity的大小可以判断元素金属性与非金属性强弱,下表列出部分短周期元素的Electronegativity的值。
元素 | X | Y | Z | W | R | Q |
electronegativity | 2.1 | 2.5 | 3.0 | 3.5 | 0.9 | 2.5 |
元素 | Mg | Li | Al | Cl | P | Be |
electronegativity | 1.2 | 1.0 | 1.5 | 3.0 | 2.1 | 1.5 |
请回答下列问题(涉及X、Y、Z、W、R、Q时,用元素符号表示):
(1)根据上表给出的数据,可知元素的electronegativity越大,__(填“金属性”或“非金属性”)越强。
(2)元素Q在周期表中的位置为_________。
(3)W、R、Q单核简单离子半径由大到小排列顺序为______。
(4)元素X、Z、W之间能形成多种10电子微粒,请写出反应物和产物均为X、Z、W之间形成的10电子微粒的一个离子方程式______________。
(5)一种由元素W、R组成的白色固体化合物,其电子式为_______________。
(6)试比较稳定性:X2W_____ X2Q;沸点:X2W_____ X2Q (填“<”或“>”)。
(7)元素 X、Y、Z、W、R、Q中的两种元素可形成原子个数比为1∶2的共价化合物,则这两种元素的原子序数之差不可能是_________。
A.2 B.4 C.5 D.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯乙酸(CCl3COOH)是饮用水中常见污染物,难以直接氧化降解。通过Fe/Cu微电池法和芬顿法可将三氯乙酸除去。
(1)pH=4时,向含有三氯乙酸的水样中投入铁屑和铜屑,通过原电池反应生成的活性氢原子(H)将CCl3COOH脱氯后转化为CHCl2COOH。
①原电池反应时的负极反应式为___。
②写出活性氢原子(H)与CCl3COOH反应的离子方程式:___。
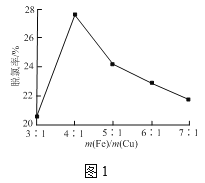
③铁屑和铜屑的总质量一定,改变铁屑和铜屑的质量比,水样中单位时间三氯乙酸的脱氯率如图1所示,当m(Fe)/m(Cu)大于4时,铁屑质量越大,脱氯率越低的原因是___。
(2)取上述反应后的溶液,向其中加入H2O2,发生图2所示转化,生成羟基自由基(·OH),·OH能将溶液中的CHCl2COOH等物质进一步脱氯除去。
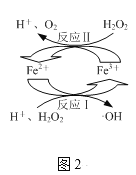
①图2所示转化中化合价未发生变化的元素是___。
②写出图2所示转化中反应Ⅱ的离子方程式:___。
③控制水样的pH不同,所得脱氯率如图3所示,当pH>4后,脱氯率逐渐下降的原因是___。

④加入H2O2后需控制溶液的温度,温度过高时脱氯率减小的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫和氮及其化合物在生产生活中应用广泛。请回答:
(1)蔗糖炭化的过程中,会发生反应:C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O,若生成0.5 mol CO2,则转移电子的物质的量是______mol,蔗糖炭化过程体现了浓H2SO4的____(选填:脱水性、吸水性、氧化性、酸性)。
CO2↑+2SO2↑+2H2O,若生成0.5 mol CO2,则转移电子的物质的量是______mol,蔗糖炭化过程体现了浓H2SO4的____(选填:脱水性、吸水性、氧化性、酸性)。
(2)实验室有一瓶放置很久的Na2SO3固体药品,小明同学想设计一个实验验证这瓶药品有没有变质?请你帮助他设计一个实验______________________________________。
(3)Cl2和SO2均可以使品红溶液褪色,将二者等体积混合通入品红,发现红色不褪去,用化学方程式解释其原因__________________________________________________。
(4)工业上可以通过氮气和氢气在一定条件下合成氨气。下列关于氨气的性质和用途描述正确的是____________。
A.氨气易液化,液氨可作制冷剂 B.可用排水法收集氨气
C.氨气是一种无色无味的气体 D.向氨水中滴加酚酞,溶液变红
(5)氨气在一定条件下还可以被氧气所氧化,请写出化学方程式_____________________
(6)实验室检验试管里氨气是否收集满的方法是___________________(写出一种即可)。
(7)25.6 g Cu与含2 mol/L的HNO3和1mol/LH2SO4的200mL混合酸充分反应,反应后收集到的气体在标准状况下的体积为___________________(假设HNO3还原产物为NO)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大, X、Z、W 均可形成酸性氧化物。X的一种氢化物分子空间构型为三角锥型,YW是氯碱工业的主要原料,Z的最外层电子数为4,请回答以下问题:
(1)表示氯碱工业生产原理的化学方程式为____________________________________。
(2)X的另一种氢化物X2H4可作为火箭推进器燃料,其结构式为__________________ 。
(3)Y的氧化物中,有一种既含离子键又含共价键,该氧化物的电子式为 ___________。
(4)Z的氧化物属于晶体,工业制备Z单质的化学方程式为________________________。
(5)W单质是毒性很大的窒息性气体。工业上用X气态氢化物的浓溶液检验W单质是否泄露,写出反应的化学方程式_________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某种兴奋剂的结构简式如图所示。有关该物质的说法中正确的是 ( )

A. 该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
B. 能使酸性KMnO4溶液褪色,证明其结构中存在碳碳双键
C. 1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为10mol和7mol
D. 该分子中的所有碳原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 都属于多环烃类,下列有关它们的说法错误的是
都属于多环烃类,下列有关它们的说法错误的是
A. 这三种有机物的二氯代物同分异构体数目相同
B. 盘烯能使酸性高锰酸钾溶液褪色
C. 棱晶烷和盘烯互为同分异构体
D. 等质量的这三种有机物完全燃烧,耗氧量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。
(1)A的结构简式为______________,名称为____________________。
(2)A中的碳原子是否都处于同一平面?________(填“是”或“不是”);A分子是否存在顺反异构体________(填“是”或“否”)。
(3)已知A、B、C有如下转化关系:
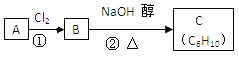
则反应②的化学方程式为____________;反应的类型是_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com