
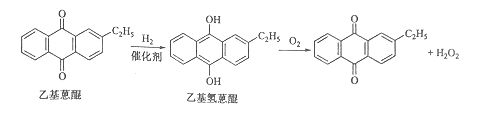
【题目】双氧水是一种重要的氧化剂、漂白剂和消毒剂。生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:
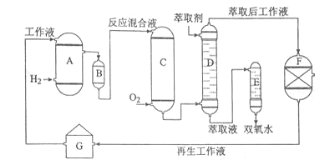
A.氢化釜 B.过滤器 C.氧化塔 D.萃取塔 E..净化塔 F.工作液再生装置 G.工作液配制装置
生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定的温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水。回答下列问题:
(1)蒽醌法制备双氧水理论上消耗的原料是_______,循环使用的原料是______,配制工作液时采用有机溶剂而不采用水的原因是______。
(2)氢化釜A中反应的化学方程式为_______,进入氧化塔C的反应混合液中的主要溶质为_______。
(3)萃取塔D中的萃取剂是____,选择其作萃取剂的原因是______。
(4)工作液再生装置F中要除净残留的H2O2,原因是______。
(5)双氧水浓度可在酸性条件下用KMnO4溶液测定,该反应的离子方程式为_______。一种双氧水的质量分数为27.5%,(密度为1.10g·cm3),其浓度为______mol/L。
【答案】氢气和氧气 乙基蒽醌 乙基蒽醌不溶于水,易溶于有机溶剂 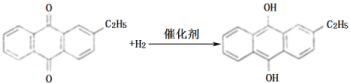 乙基氢蒽醌 水 过氧化氢易溶于水被水萃取,乙基蒽醌不溶于水 过氧化氢分解放出氧气,与氢气混合,易发生爆炸 6H++5H2O2+2MnO4-=2Mn2++5O2↑+8H2O 8.9
乙基氢蒽醌 水 过氧化氢易溶于水被水萃取,乙基蒽醌不溶于水 过氧化氢分解放出氧气,与氢气混合,易发生爆炸 6H++5H2O2+2MnO4-=2Mn2++5O2↑+8H2O 8.9
【解析】
乙基蒽醌溶于有机溶剂配制成工作液,工作液在A中催化加氢生成乙基氢蒽醌,乙基氢蒽醌在B中被氧气氧化成乙基蒽醌,同时生成过氧化氢,将生成过氧化氢后的混合液用水萃取,可得过氧化氢溶液,有机层主要含乙基蒽醌,通过再生装置处理可重新配制成工作液进行循环,整个过程中实际参加反应的只有氢气和氧气,据此解答。
(1)由转化反应可知,乙基蒽醌先与氢气发生加成反应生成乙基氢蒽醌,乙基氢蒽醌再与氧气发生氧化反应生成乙基蒽醌和过氧化氢,则蒽醌法制备双氧水理论上消耗的原料是氢气和氧气。乙基蒽醌开始被消耗,后来又生成,则循环使用的原料是乙基蒽醌,且结合流程图中再生工作液环节可知乙基蒽醌可循环使用,配制工作液时采用有机溶剂而不采用水的原因是乙基蒽醌不溶于水,易溶于有机溶剂,故答案为:氢气和氧气;乙基蒽醌;乙基蒽醌不溶于水,易溶于有机溶剂;
(2)由原理和流程可知,A中乙基蒽醌与氢气发生加成反应,反应为 ,进入氧化塔C的反应混合液中的主要溶质为产物乙基氢蒽醌,故答案为:
,进入氧化塔C的反应混合液中的主要溶质为产物乙基氢蒽醌,故答案为: ;乙基氢蒽醌;
;乙基氢蒽醌;![]() 中萃取分离出过氧化氢溶液,则选择萃取剂为水,选择其作萃取剂的原因是过氧化氢易溶于水被水萃取,乙基蒽醌不溶于水,故答案为:水;过氧化氢易溶于水被水萃取,乙基蒽醌不溶于水;
中萃取分离出过氧化氢溶液,则选择萃取剂为水,选择其作萃取剂的原因是过氧化氢易溶于水被水萃取,乙基蒽醌不溶于水,故答案为:水;过氧化氢易溶于水被水萃取,乙基蒽醌不溶于水;![]() 工作液再生装置F中要除净残留的
工作液再生装置F中要除净残留的![]() ,原因是过氧化氢分解放出氧气,与氢气混合,易发生爆炸,故答案为:过氧化氢分解放出氧气,与氢气混合,易发生爆炸;
,原因是过氧化氢分解放出氧气,与氢气混合,易发生爆炸,故答案为:过氧化氢分解放出氧气,与氢气混合,易发生爆炸;![]() 双氧水在酸性条件下与
双氧水在酸性条件下与![]() 溶液发生氧化还原反应生成氧气,离子反应为6H++5H2O2+2MnO4-=2Mn2++5O2↑+8H2O,由
溶液发生氧化还原反应生成氧气,离子反应为6H++5H2O2+2MnO4-=2Mn2++5O2↑+8H2O,由![]() 可知一种双氧水的质量分数为
可知一种双氧水的质量分数为![]() 密度为
密度为![]() ,其浓度=
,其浓度=![]() ,故答案为:6H++5H2O2+2MnO4-=2Mn2++5O2↑+8H2O;8.9。
,故答案为:6H++5H2O2+2MnO4-=2Mn2++5O2↑+8H2O;8.9。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。下列说法不正确的是
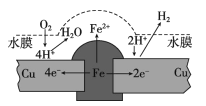
A. 腐蚀过程中铜极上始终只发生: 2H++2e-= H2↑
B. 若水膜中溶有食盐将加快铁铆钉的腐蚀
C. 若在金属表面涂一层油脂能防止铁铆钉被腐蚀
D. 若将该铜板与直流负极相连,则铁铜均难被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号 | I | II | III |
实验步骤 |
充分振荡,加2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去, 变成蓝色,加入蒸馏水后无白色沉淀 |
下列说法不正确的是( )
A.实验I、II、III中均发生了反应2Fe3++Cu=2Fe2++Cu2+
B.对比实验I、II、III说明白色沉淀的产生可能与铜粉的量及溶液的阴离子种类有关
C.实验I、III中加入蒸馏水后c(Cu2+)相同
D.向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知卤代烃可与金属钠反应:R-X+2Na+R′-X ![]() R-R′+2NaX下列有机物可以合成环丙烷的是
R-R′+2NaX下列有机物可以合成环丙烷的是
A. CH3CH2CH2BrB. CH3CHBrCH2Br
C. CH2BrCH2CH2BrD. CH3CHBrCH2CH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质的分子式或结构简式:
(1)1L烷烃C的蒸气完全燃烧时,生成同温同压下15L水蒸气:__________。
(2)分子式为CmH20的烷烃中m为________。
(3)碳、氢原子个数之比为2∶5的烷烃的分子式为__________,它的同分异构体的结构简式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科大发现了人工合成金刚石的新方法,化学原理为:Na+CO2![]() C(金刚石)+C(石墨)+Na2CO3(未配平),这种合成具有深远的意义。下列说法不正确的是
C(金刚石)+C(石墨)+Na2CO3(未配平),这种合成具有深远的意义。下列说法不正确的是
A. 该反应中,钠作还原剂,二氧化碳作氧化剂
B. 每生成1mol Na2CO3时,共转移4mol电子
C. 该反应中Na2CO3是氧化产物
D. 还原性Na大于C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以饱和食盐水、NH3和CO2为原料,可以制取纯碱。下列说法正确的是( )
A.由反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0可知反应物所含键能总和大于生成物所含键能总和
2NH3(g) ΔH<0可知反应物所含键能总和大于生成物所含键能总和
B.常温常压下,电解饱和食盐水时,每生成2.24LCl2,电路中转移0.2mol电子
C.室温下,稀释纯碱溶液时,溶液的pH减小
D.反应Na2O(s)+CO2(g)=Na2CO3(s)常温下可自发进行,该反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2与Cl2的氧化性相近。在自来水消毒和果蔬保鲜等方面应用广泛。
Ⅰ.实验室制备Cl2的离子方程式____________________________。
Ⅱ.某兴趣小组通过下图装置(夹持装置略)ClO2对制备、吸收、释放和应用进行了研究。
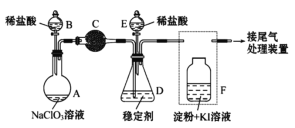
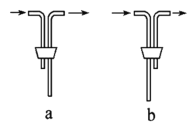
(1)仪器B的名称是___________。安装F中导管时,应选用上图中的_________。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。为使ClO2 在D中被稳定剂充分吸收,滴加稀盐酸的速度宜___________ (填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是___________ 。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为__________________,装置F中的现象是________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com