
【题目】砷及其化合物被运用在农药、除草剂、杀虫剂与多种合金中,其中三氧化二砷(AS2O3)被称为砒霜,是一 种毒性很强的物质。回答下列问题:
(1)As在元素周期表中的位置是_____________,AsH3的电子式_________。
(2)一定条件下,雄黄(As4S4)与As2O3的转化关系如图所示。若该反应中1mol As4S4(其中As元素的化合价为+2)参加反应时,转移28mole-,则物质a为_________(填化学式)。

(3)焦炭真空冶炼砷时需加入催化剂,其中部分反应的热化学方程式如下:
反应 I .As2O3(g) +3C(s) ![]() 2As(g) +3CO(g)
2As(g) +3CO(g) ![]() =a kJ· mol-1
=a kJ· mol-1
反应 II.As2O3(g) +3C(s) ![]()
![]() As4(g) +3CO(g)
As4(g) +3CO(g) ![]() =b kJ ·mol-1
=b kJ ·mol-1
反应III.As4(g) ![]() 4As(g)
4As(g) ![]()
① ![]() =_________kJ ·mol-1 (用含a,b的代数式表示)。
=_________kJ ·mol-1 (用含a,b的代数式表示)。
②反应中催化剂的活性会因为反应II[生成As4(g)]的发生而降低,同时存在的反应III可使As4(g)的量减少。已知催化剂X、Y的相关数据如表所示:
反应II | 反应III | ||
活化能/ (kJ ·mol -1 ) | 催化剂X | 56 | 75 |
催化剂Y | 37 | 97 | |
由表中数据判断催化剂X_______ (填“优于”或“劣于”)催化剂Y。
(4)298 K 时,将 20mL 3xmol·L-1 Na3AsO3溶液、20 ml 3xmol·L-l I2溶液和 20mL 6xmol· L-l NaOH 溶液混合(忽略溶液体积变化),发生反应:![]() (aq) +I2(aq) +2OH-(aq)
(aq) +I2(aq) +2OH-(aq)![]()
![]() (aq) +2I-(aq) +H2O(l)。溶液中 c(
(aq) +2I-(aq) +H2O(l)。溶液中 c(![]() )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
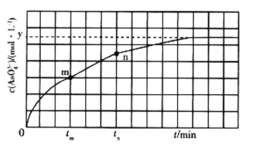
①下列可说明反应达到平衡的是_______ (填标号)。
a.v(I- ) =2v(![]() )
)
b.溶液的c(OH-)不再发生变化
c.c(I-) =ymol· L-1
d.c(![]() )/c(
)/c(![]() )不再发生变化
)不再发生变化
e.c(Na+) =5xmol· L-1
②tm min时,v正(![]() )_______ (填“大于”“小于”或“等于”)v逆(
)_______ (填“大于”“小于”或“等于”)v逆( ![]() )。
)。
③tm min时v逆( ![]() ) _______ (填“大于”“小于”或“等于”)tn时v逆(
) _______ (填“大于”“小于”或“等于”)tn时v逆( ![]() ),理由是___________________。
),理由是___________________。
【答案】第四周期第ⅴA族 ![]() SO2 2a-2b 优于 bd > < tm时生成物浓度较低
SO2 2a-2b 优于 bd > < tm时生成物浓度较低
【解析】
(1)As是33号元素,根据其核外电子排布规律确定元素周期表中的位置;AsH3是共价化合物,据此写出电子式;
(2)根据题给信息,结合氧化还原反应规律确定反应中消耗氧气的量,根据原子守恒确定产物的化学式;
(3)①根据盖斯定律进行计算;
②反应的活化能越小,反应速率越快,根据表格数据和题给信息(反应中催化剂的活性会因为发生反应Ⅱ(生成As4)而降低,同时存在的反应Ⅲ使As4量减少),相对于催化剂Y,使用催化剂X时,反应Ⅱ(生成As4)的活化能更大,生成As4的反应速率小,从而降低副反应Ⅱ的进行程度,并且反应Ⅲ活化能相对较小,消耗As的反应速率大,使As4尽可能转化为As;
(4)①根据反应达到平衡时,正逆反应速率相等,各组分的浓度保持不变进行平衡状态的分析;
②结合图像分析,反应从正反应方向开始进行,tm时反应继续正向进行;
③结合图像分析,tm时AsO43-的浓度比tn时小,所以逆反应速率v(tm)<v(tn)。
(1)As是33号元素,在元素周期表中的位置是第四周期第ⅤA族,AsH3是共价化合物,电子式为![]() ,故本题答案为:第四周期第ⅴA族;
,故本题答案为:第四周期第ⅴA族;![]() ;
;
(2)若该反应中1mol As4S4参加反应时,转移28mole-,则消耗了7mol氧气,则化学方程式为:As4S4+7O2=2As2O3+4SO2,物质a为SO2,本题答案为:SO2;
(3)①反应 I .As2O3(g) +3C(s)![]() 2As(g) +3CO(g)
2As(g) +3CO(g) ![]() =a kJ· mol-1
=a kJ· mol-1
反应 II.As2O3(g) +3C(s)![]()
![]() As4(g) +3CO(g)
As4(g) +3CO(g)![]() =b kJ ·mol-1
=b kJ ·mol-1
反应III.As4(g)![]() 4As(g)
4As(g)![]()
由盖斯定律有:反应III=反应Ⅰ×2-反应Ⅱ×2,得到As4(g)![]() 4As(g)
4As(g)![]() =(2a-2b)kJ ·mol-1,故答案为2a-2b;
=(2a-2b)kJ ·mol-1,故答案为2a-2b;
②反应的活化能越小,反应速率越快,根据表格数据和题给信息(反应中催化剂的活性会因为发生反应Ⅱ(生成As4)而降低,同时存在的反应Ⅲ使As4量减少),相对于催化剂Y,使用催化剂X时,反应Ⅱ(生成As4)的活化能更大,生成As4的反应速率小,从而降低副反应Ⅱ的进行程度,并且反应Ⅲ活化能相对较小,消耗As的反应速率大,使As4尽可能转化为As,所以催化剂X优于催化剂Y,本题答案为:优于;
(4)①a.题中未指出是正反应速率还是逆反应速率,不能判断,a项错误;
b.溶液的c(OH-)不变,则pH也保持不变,所以体系中各组分的浓度均不再变化,反应处于平衡状态,b项正确;
c.由题图知,平衡时c(I-)=2c(AsO43-)=2y mol/L所以c(I-)=y mol/L时反应不是平衡状态,c项错误;
d.由于As元素的总量一定,所以c(![]() )/c(
)/c(![]() )不再发生变化,c(
)不再发生变化,c(![]() )与c(
)与c(![]() )均保持不变,反应处于平衡状态,d项正确;
)均保持不变,反应处于平衡状态,d项正确;
e.由离子方程式可知,钠离子不参与反应,故钠离子的浓度一直不变,当c(Na+)=5xmol· L-1,不能判断反应是否平衡,e项错误;
故选bd。
②反应从正反应方向开始进行,tm时反应继续正向进行,故v(正)>v(逆),本题答案为:>;
③tm时AsO43-的浓度比tn时小,所以逆反应速率v(tm)<v(tn),故本题答案为:<;tm时生成物浓度较低。


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】三氯乙酸(CCl3COOH)是饮用水中常见污染物,难以直接氧化降解。通过Fe/Cu微电池法和芬顿法可将三氯乙酸除去。
(1)pH=4时,向含有三氯乙酸的水样中投入铁屑和铜屑,通过原电池反应生成的活性氢原子(H)将CCl3COOH脱氯后转化为CHCl2COOH。
①原电池反应时的负极反应式为___。
②写出活性氢原子(H)与CCl3COOH反应的离子方程式:___。
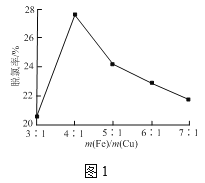
③铁屑和铜屑的总质量一定,改变铁屑和铜屑的质量比,水样中单位时间三氯乙酸的脱氯率如图1所示,当m(Fe)/m(Cu)大于4时,铁屑质量越大,脱氯率越低的原因是___。
(2)取上述反应后的溶液,向其中加入H2O2,发生图2所示转化,生成羟基自由基(·OH),·OH能将溶液中的CHCl2COOH等物质进一步脱氯除去。
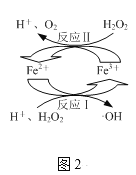
①图2所示转化中化合价未发生变化的元素是___。
②写出图2所示转化中反应Ⅱ的离子方程式:___。
③控制水样的pH不同,所得脱氯率如图3所示,当pH>4后,脱氯率逐渐下降的原因是___。

④加入H2O2后需控制溶液的温度,温度过高时脱氯率减小的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 都属于多环烃类,下列有关它们的说法错误的是
都属于多环烃类,下列有关它们的说法错误的是
A. 这三种有机物的二氯代物同分异构体数目相同
B. 盘烯能使酸性高锰酸钾溶液褪色
C. 棱晶烷和盘烯互为同分异构体
D. 等质量的这三种有机物完全燃烧,耗氧量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A. (CH3)2C=CH2的名称为2-甲基-1-丁烯
B. 丙烷的二氯代物有4种同分异构体
C. 苯分子的碳碳双键可与氢气发生加成反应
D. CH3-CH=CH-C![]() C-CH3分子中所有碳原子不可能在同一平面上
C-CH3分子中所有碳原子不可能在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
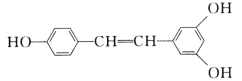
【题目】白藜芦醇广泛存在于食物(例如桑甚、花生,尤其是葡萄)中,它可能具有抗癌性。能够与1 mol该化合物发生反应的Br2和H2的最大用量分别是( )
A.1mol、1molB.3.5mol、7mol
C.3.5mol、6molD.6mol、7mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,则这个碳原子被称为“手性碳原子”,凡含有手性碳原子的物质一定具有光学活性,如物质 有光学活性,发生下列反应后生成的有机物无光学活性的是( )
有光学活性,发生下列反应后生成的有机物无光学活性的是( )
①与甲酸发生酯化反应 ②与NaOH溶液反应 ③与银氨溶液作用 ④在催化剂存在下与氢气作用
A. ①③B. ②④
C. ①④D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。
(1)A的结构简式为______________,名称为____________________。
(2)A中的碳原子是否都处于同一平面?________(填“是”或“不是”);A分子是否存在顺反异构体________(填“是”或“否”)。
(3)已知A、B、C有如下转化关系:
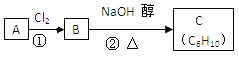
则反应②的化学方程式为____________;反应的类型是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋酸钠(NaBiO3)是分析化学中的重要试剂,在水中缓慢分解,遇沸水或酸则迅速分解。某兴趣小组设计实验制取铋酸钠并探究其应用。回答下列问题:
Ⅰ.制取铋酸钠
制取装置如图(加热和夹持仪器已略去),部分物质性质如下:
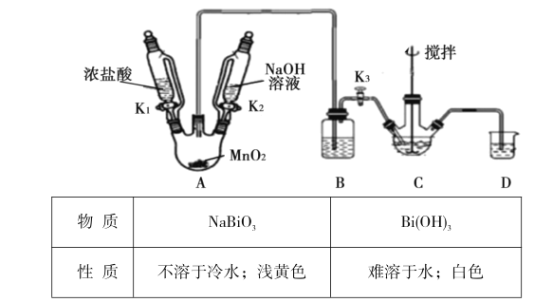
(1)C中盛放Bi(OH)3与NaOH的混合物,与Cl2反应生成NaBiO3,反应的化学方程式为__。B装置的作用是__。
(2)当观察到__(填现象)时,可以初步判断C中反应已经完成。
(3)拆除装置前必须先除去残留的Cl2,以免污染空气。除去烧瓶A中残留Cl2的操作是:关闭__;打开__。
(4)反应结束后,为从装置C中获得尽可能多的产品,需要的操作有_。
Ⅱ.铋酸钠的应用——检验Mn2+
(5)往待检液中加入铋酸钠晶体,加硫酸酸化,生成Bi3+,且溶液变为紫红色,证明待检液中存在Mn2+。产生紫红色现象的离子方程式为__。
Ⅲ.产品纯度的测定
(6)取上述NaBiO3产品ag,加入足量稀硫酸和MnSO4稀溶液使其完全反应,再用bmo1L-1的H2C2O4标准溶液滴定生成的MnO4-(已知:H2C2O4+MnO4-—CO2+Mn2++H2O,未配平),当溶液紫红色恰好褪去时,消耗cmL标准溶液。该产品的纯度为__(用含a、b、c的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com