
【题目】草酸(H2C2O4)是一种易溶于水的二元中强酸,KHC2O4溶液显酸性。现称取5.0g含H2C2O42H2O、KHC2O4和K2SO4的固体样品,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。第一份溶液中加入2滴酚酞试液,滴加0.2500mol/LNaOH溶液,滴定终点时消耗NaOH溶液16.00mL。第二份溶液用0.1000mol/L酸性KMnO4溶液滴定,当加入12.00mL酸性KMnO4溶液时恰好反应完全。
(1)K2C2O4溶液呈碱性的原因(用离子方程式表示)_______________________________。
(2)在该实验中不需要用到的实验仪器有___________(填字母编号)。
A.容量瓶 B.酸式滴定管 C.碱式滴定管 D.分液漏斗 E.锥形瓶 F.圆底烧瓶
(3)第一份用NaOH溶液滴定时,滴定终点的判断依据为____________________________________。
(4)原试样中KHC2O4的质量分数为__________%(保留3位有效数字)。
(5)如果用0.2500mol/LNaOH溶液滴定第一份溶液的实验中,在滴定终点时俯视读数。则测得的KHC2O4的质量分数_________(填“偏高”、“偏低”或“无影响”)。
【答案】C2O42—+H2O![]() HC2O4—+OH— D、F 当滴入一滴NaOH溶液时,溶液颜色恰好由无色到粉(浅)红色且半分钟内不褪色,即达到滴定终点 51.2 偏高
HC2O4—+OH— D、F 当滴入一滴NaOH溶液时,溶液颜色恰好由无色到粉(浅)红色且半分钟内不褪色,即达到滴定终点 51.2 偏高
【解析】
H2C2O42H2O、KHC2O4和K2SO4的固体样品,配成溶液。分别用NaOH溶液和酸性KMnO4溶液滴定,在用NaOH溶液滴定过程中,1molH2C2O4 消耗2mol NaOH,1mol KHC2O4消耗1mol NaOH,在用酸性KMnO4溶液滴定过程中,2mol MnO4-消耗5mol C2O42-,据此分析;
(1)K2C2O4属于强碱弱酸盐,溶液呈碱性的原因为: C2O42—+H2O![]() HC2O4—+OH— ;
HC2O4—+OH— ;
(2)配制溶液过程中需要容量瓶,滴定过程中需要酸式滴定管、碱式滴定管、锥形瓶,故不需要用到的实验仪器有D、F;
(3)溶液显酸性,用NaOH溶液滴定时,滴定终点的判断依据为当滴入一滴NaOH溶液时,溶液颜色恰好由无色到粉(浅)红色且半分钟内不褪色,即达到滴定终点;
(4)由得失电子守恒可知2MnO4- ~ 5C2O42-
12×10-3×0.1mol 3×10-3mol
设滴定前溶液中含有H2C2O4 x mol、 KHC2O4 y mol。向溶液中加入NaOH时
H2C2O4 ~ 2NaOH
x mol 2x mol
HC2O4- ~NaOH
y mol y mol
由题意可知2x+y=16×10-3×0.25,x+y=3×10-3,解得x=1×10-3mol ,y=2×10-3mol,则固体样品中m( KHC2O4)= 2×10-3×128=0.256g,KHC2O4的质量分数=0.256/0.5×100%=51.2%
(5)用NaOH溶液滴定过程中,在滴定终点时俯视读数,使消耗NaOH的体积偏小,即2x+y偏小,x+y不变,则KHC2O4的质量分数偏高;


科目:高中化学 来源: 题型:
【题目】课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:

(1)电源A 极的名称是________。
(2)甲装置中电解反应的总化学方程式是__________________。
(3)如果收集乙装置中产生的气体,两种气体的体积比是________。
(4)欲用丙装置精炼铜,G应该是____(填“纯铜”或“粗铜”),电解液的成分是______。
(5)已知氢氧化铁胶体中含有带正电荷的红褐色的粒子,那么装置丁中的现象是________________。
(6)在实验室电解500 mL 0.03 mol/L的NaCl溶液,通电一段时间后溶液中c(OH-)为1×10-2 mol/L(设电解时溶液的体积变化忽略不计),阴极产生___mL(标况)气体,溶液中NaCl的浓度为_______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于 Na2CO3 和NaHCO3的说法中正确的是
A. 热稳定性: NaHCO3比Na2CO3稳定
B. 常温时,在水中的溶解性: Na2CO3>NaHCO3
C. 氢氧化铝和纯碱常用来治理胃酸过多
D. 它们都属于盐类,所以水溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Mg(OH)2的溶解平衡时,利用下表三种试剂进行试验,下列说法中不正确的是
编号 | ① | ② | ③ |
分散质 | Mg(OH)2 | HCl | NH4Cl |
备注 | 悬浊液 | 1 mol/L | 1 mol/L |
A. 向①中滴入几滴酚酞试液后,溶液显红色说明Mg(OH)2是一种弱电解质
B. 为了使Mg(OH)2悬浊液溶解得更快,加入过量的NH4Cl浓溶液并充分振荡,效果更好
C. ①、③混合后发生反应:Mg(OH)2(s)+2NH4+(aq)![]() Mg2+(aq)+2NH3·H2O(aq)
Mg2+(aq)+2NH3·H2O(aq)
D. 向①中加入②,H+与OH—反应生成H2O,使c(OH-)减小,Mg(OH)2溶解平衡向溶解方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,H2R及其钠盐的混合溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH的变化关系如图所示。下列叙述错误的是
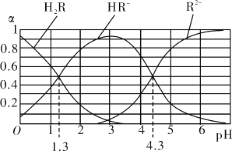
A. 由图可知:H2R的pKa1=1.3(已知:pKa= -lgKa)
B. 在pH=4.3的溶液中:3c(R2-) > c(Na+)
C. 0.2mol/L H2R溶液与0.3mol/L NaOH溶液等体积混合后的溶液中pH=4.3
D. 在pH=3的溶液中存在 ![]() =10-3
=10-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯M常用作调制具有草莓、葡萄、樱桃等香味的食用香精。M属于芳香化合物,苯环上只含一个直支链,能发生加聚反应和水解反应。测得M的摩尔质量为162 g·mol-1,只含碳、氢、氧三种元素,且原子个数之比为5∶5∶1。
(1)肉桂酸甲酯的结构简式是___________________________。
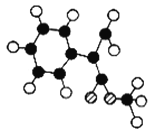
(2)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如图所示(图中球与球之间连线表示单链或双键)。G的结构简式为_____________。
(3)以芳香烃A为原料合成G的路线如下:
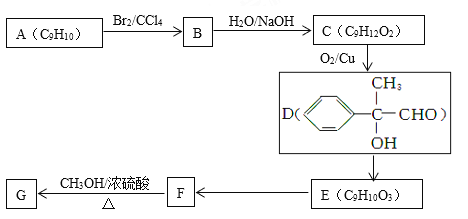
①化合物E中的含氧官能团有_____________(填名称)。
②E→F的反应类型是__________,F→G的化学方程式为______________________。
③符合下列条件的F的同分异构体中:
Ⅰ.分子内含苯环,且苯环上只有一个支链;不含“―O―O―”和“―C≡C―”;
Ⅱ.在催化剂作用下,1 mol该物质与足量氢气充分反应,消耗5 mol H2;
Ⅲ.它不能发生水解反应,不能发生酯化反应。
其中能与银氨溶液反应,且1mol该有机物与析出的银的物质的量之比为1∶4的是_________________________________(写结构简式);其中核磁共振氢谱图中有6个峰,且峰面积之比为1∶1∶1∶1∶2∶2的是 _________________________(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2 (g)+B2 (g)=2AB (g)的能量变化如图所示,下列叙述正确的是
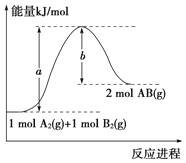
A. 该反应每生成2分子AB吸收(a-b)kJ能量
B. 该反应中反应物的总能量高于生成物的总能量
C. 该反应的反应热ΔH=+(a-b) kJ·mol-1
D. 断裂1molA-A键和1molB-B键,放出akJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示,下列说法不正确的是

A. b点对应的Ksp等于c点对应的Ksp
B. 采取蒸发溶剂的方法可以使溶液从a点变到b点
C. 该温度下,Ag2SO4的Ksp=1.6×10-5
D. 0.02 mol·L-1的AgNO3溶液与0.2 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验结果不能作为相应定律或原理的证据之一的是( )
(阿伏加德罗定律:在同温同压下,相同体积的任何气体含有相同数目的分子)
A | B | C | D | |
勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏伽德罗定律 | |
实验方案 |
|
|
|
|
结果 | 左球气体颜色加深 右球气体颜色变浅 | 烧瓶中冒气泡 试管中出现浑浊 | 测得 |
|
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com