
【题目】常温下,铁与下列酸溶液作用产生H2的是( )
A.浓硫酸B.稀硫酸C.浓硝酸D.稀硝酸
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A. 以石墨为电极电解MgCl2溶液:2Cl—+2H2O![]() Cl2+H2↑+2OH—
Cl2+H2↑+2OH—
B. CuC12溶液中加入氨水:Cu2++2OH- Cu(OH)2↓
C. KI溶液中滴入稀硫酸,空气中振荡:4H++4I-+O2 2I2+2H2O
D. 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH![]() +OH-
+OH-![]() NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:常温下甲胺(CH3NH2)的电离常数kb,pkb=-lgkb=3.4。CH3NH2+H2O![]() CH3NH3++OH-。下列说法不正确的是( )
CH3NH3++OH-。下列说法不正确的是( )
A. (CH3NH3)2SO4溶液中离子浓度:c(CH3NH3+)>c(SO42-)>c(H+)>c(OH-)
B. 常温下,pH=3的盐酸溶液和pH=11的CH3NH2溶液等体积混合,混合溶液呈酸性
C. 用标准浓度的盐酸滴定未知浓度的CH3NH2溶液的实验中,选择甲基橙作指示剂
D. 常温下向CH3NH2溶液滴加稀硫酸至c(CH3NH2)=c(CH3NH3+)时,溶液pH=10.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于放热反应COCl2(g) ![]() CO(g) + Cl2(g)。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
CO(g) + Cl2(g)。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A. ①②④B. ④⑥C. ②③⑤D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pNi=-lgc(Ni2+);常温下,K(NiCO3)=1.4×10-7,H2S的电离平衡常数:Ka1=1.3×10-7,Ka2=7.1×10-15。常温下,向10mL0.1mol·L-1Ni(NO3)2溶液中滴加0.1mol·L-1Na2S溶液,滴加过程中pNi与Na2S溶液体积的关系如图所示。下列说法不正确的是( )。
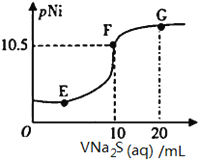
A. E、F、G三点中,F点对应溶液中水电离程度最小
B. 常温下,Ksp(NiS)=1×10-21
C. 在NiS和NiCO3的浊液中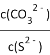 =1.4×1014
=1.4×1014
D. Na2S溶液中,S2-第一步水解常数Kh1=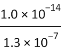
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED(Light EmittingDiode)即发光二极管,是一种能够将电能转化为光能的固态半导体器件。如图是某课外活动小组设计的用化学电源使LED灯发光的装置。下列说法不正确的是( )

A. 溶液中SO42-向铜片附近移动
B. 铜片上发生的反应为2H++2e-=H2↑
C. 导线中电子由锌片流向铜片
D. 如果将锌片换成铁片,则电路中的电流方向不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)湿法制各高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42—、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:______________________________
②每生成l mol FeO42-转移__________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为____mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4)原因是__。
(2)工业上从海水中提取单质溴可采用如下方法:
①向海水中通入Cl2将海水中溴化物氧化,其离子方程式为____。
②向上述混合液中吹入热空气,将生成的溴吹出,用纯碱溶液吸收,其化学方程式为__。
③将②所得溶液用H2SO4酸化,使NaBr、NaBrO3中的溴转化为单质溴,再用有机溶剂提取溴后,还可得到副产品Na2SO4。这一过程可用化学方程式表示为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1934年居里夫妇用α粒子(4He)轰击27Al得到一种自然界中不存在的P的一种同位素——![]() P,开创了人造核素的先河:
P,开创了人造核素的先河:![]() Al+
Al+![]() He→
He→![]() P+
P+![]() n。下列有关说法不正确的是( )
n。下列有关说法不正确的是( )
A. 该变化说明原子核在化学反应中也能发生变化
B. 该变化遵循质量守恒定律
C. ![]() n是一种电中性粒子
n是一种电中性粒子
D. 对于30P:原子序数=质子数=中子数=核外电子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com