
【题目】I.化工工业中常用乙苯脱氢的方法制备苯乙烯.
已知某温度下:
反应①:CO2(g)+H2(g)→CO(g)+H2O(g),△H=+41.2kJ/mol;
反应②: ![]() (g)→
(g)→ ![]() (g)+H2(g),△H=+117.6kJ/mol;
(g)+H2(g),△H=+117.6kJ/mol;
①②的化学反应平衡常数分别为K1、K2 ,
(1)请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式
该反应的化学平衡常数K=(用K1、K2表示)
(2)恒温恒容条件下,反应①达到平衡后;t1时刻通入少量CO2;请在图中画出t1之后的正逆反应曲线,并作出标注. 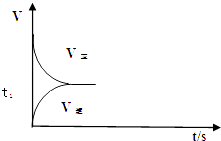
(3)Ⅱ.一定的条件下,合成氨反应为:N2(g)+3H2(g)2NH3(g).图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线.图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响. 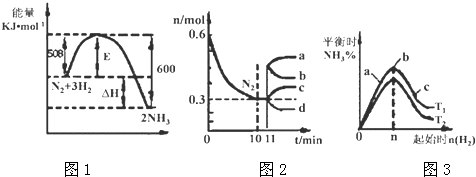
升高温度,该反应的平衡常数(填“增大”或“减小”或“不变”).
(4)由图2信息,计算10min内该反应的平均速率v(H2)= , 从11min起其它条件不变,压缩容器的体积,则n(N2)的变化曲线为(填“a”或“b”或“c”或“d”)
(5)图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是点,温度T1T2(填“>”或“=”或“<”)
【答案】
(1)CO2(g)+ 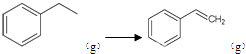 +CO(g)+H2O(g)△H=+158.8 kJ/mol;K1?K2
+CO(g)+H2O(g)△H=+158.8 kJ/mol;K1?K2
(2)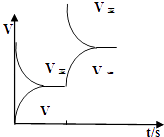
(3)减小
(4)0.045mol/(L?min);d
(5)c;<
【解析】解:(1.)已知反应①:CO2(g)+H2(g)→CO(g)+H2O(g)△H=+41.2kJ/mol;
反应②: ![]() (g)→
(g)→ ![]() (g)+H2(g)△H=+117.6kJ/mol;根据盖斯定律:①+②,得 CO2(g)+
(g)+H2(g)△H=+117.6kJ/mol;根据盖斯定律:①+②,得 CO2(g)+ 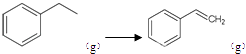 +CO(g)+H2O(g)△H=+41.2+117.6=+158.8kJ/mol,反应①与②相加得总方程,则总方程的平衡常数等于分方程的平衡常数之积,即K=K1K2 , 所以答案是:CO2(g)+
+CO(g)+H2O(g)△H=+41.2+117.6=+158.8kJ/mol,反应①与②相加得总方程,则总方程的平衡常数等于分方程的平衡常数之积,即K=K1K2 , 所以答案是:CO2(g)+ 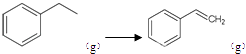 +CO(g)+H2O(g)△H=+158.8 kJ/mol;K1K2;
+CO(g)+H2O(g)△H=+158.8 kJ/mol;K1K2;
(2.)恒温恒容条件下,反应①达到平衡后;t1时刻通入少量CO2 , 则正反应速率瞬间增大,逆反应速率逐渐增大,其t1之后的正逆反应曲线为: 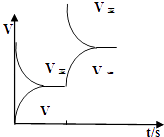 ,
,
所以答案是: 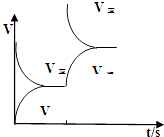 ;
;
(3.)Ⅱ.N2(g)+3H2(g)2NH3(g),反应的焓变△H=﹣(600KJ/mol﹣508KJ/mol)=﹣92KJ/mol;图2分析可知反应进行的氮气的起始量为0.6mol,反应过程中消耗氮气物质的量为0.3mol,依据热化学方程式计算得到反应过程中放热=92KJ/mol×0.3mol=27.6KJ;图象1分析可知反应是放热反应,反应物能量高于生成物能量,温度升高平衡逆向进行,平衡常数减小,所以答案是:减小;
(4.)图象分析2L的密闭容器中,V(N2)= ![]() V(H2)=
V(H2)= ![]() =0.015mol/Lmin,V(H2)=0.045mol/Lmin;从11min起其它条件不变,压缩容器的体积为1L,压强增大,平衡正向进行,瞬间氮气物质的量不变,随平衡正向进行,氮气物质的量减小,则n(N2)的变化曲线d符合;所以答案是:0.045mol/Lmin;d;
=0.015mol/Lmin,V(H2)=0.045mol/Lmin;从11min起其它条件不变,压缩容器的体积为1L,压强增大,平衡正向进行,瞬间氮气物质的量不变,随平衡正向进行,氮气物质的量减小,则n(N2)的变化曲线d符合;所以答案是:0.045mol/Lmin;d;
(5.)图3表示平衡时氨气含量与氢气起始物质的量关系,曲线上各点都处于平衡状态,故a、b、c都处于平衡状态,达平衡后,增大氢气用量,氮气的转化率增大,故a、b、c三点中,c的氮气的转化率最高;由图3可知,氢气的起始物质的量相同时,温度T1平衡后,氨气的含量更高,该反应为放热反应,降低温度平衡向正反应移动,故温度T1<T2 , 温度越高化学平衡越低,故K1>K2;所以答案是:c;<.
【考点精析】掌握化学平衡状态本质及特征和化学平衡的计算是解答本题的根本,需要知道化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】按如图装置实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示( )
①c(Ag+) ②c(AgNO3) ③a棒的质量 ④b棒的质量 ⑤溶液的pH.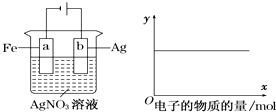
A.①③
B.③④
C.①②⑤
D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫的氧化物、氮的氧化物是常见的大气污染物。
(1)酸雨是降水呈酸性(pH小于5.6)的统称,个别地方甚至低于2.1(食醋的pH=3)。引起酸雨的罪魁祸首是大气中的硫的氧化物和氮的氧化物,它们的主要来源是煤和石油的燃烧。
①汽车排放的尾气、硝酸厂和化肥厂的废气中都含有氮的氧化物,全世界每年排放量约为5×107 kg。NO2溶于水生成_____________(写名称)和NO。
②为了减少酸雨的形成,必须减少SO2的排放量,对燃料中的硫元素进行固化处理,对废气中的氮的氧化物用__________吸收,写出NO2与之反应的离子方程式____________________________。
(2)某化学兴趣小组选用下图实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量。
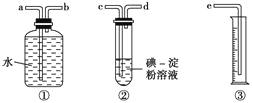
①若原料气从左向右流时,上述装置连接的顺序是:原料气→ → → → → (填字母)。_________
②装置②中发生反应的离子方程式为:___________________________________________;当装置②中出现_____________________________现象时,立即停止通气。
③你认为下列试剂中,可以用来代替试管中的碘的淀粉溶液的是__________。
A.酸性KMnO4溶液 B.NaOH溶液 C.溴水 D.氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案,不能测定![]() 和
和![]() 混合物中
混合物中![]() 质量分数的是
质量分数的是
A. 取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
B. 取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C. 取a克混合物充分加热,减重b克
D. 取a克混合物与足量![]() 溶液充分反应,过滤、洗涤、烘干,得b克固体
溶液充分反应,过滤、洗涤、烘干,得b克固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙以及物质D、E、F、G、H。它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
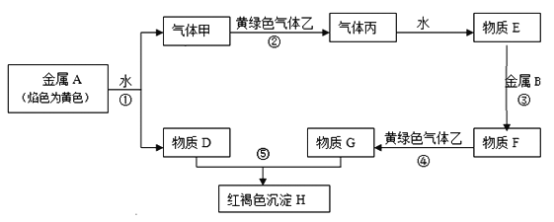
请回答下列问题:
(1)丙的化学式是________________。
(2)写出下列反应的化学方程式,是离子反应的写离子方程式:
反应①_______;反应②________;反应⑤__________。
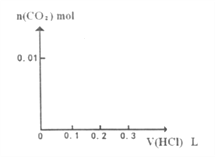
(3)将0.4gD和1.06g![]() 混合并配成溶液,向溶液中滴加0.1
混合并配成溶液,向溶液中滴加0.1![]() 稀盐酸。在下面坐标系中画出能正确表示加入盐酸的体积和生成
稀盐酸。在下面坐标系中画出能正确表示加入盐酸的体积和生成![]() 的物质的量的关系图像__________。
的物质的量的关系图像__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列反应方程式,有机物必须写结构简式,并配平,有特殊条件注明条件.
(1)实验室制备乙炔
(2)淀粉水解
(3)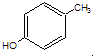 对甲基苯酚与溴水反应
对甲基苯酚与溴水反应
(4)![]() 环已二烯与氯气1,4加成
环已二烯与氯气1,4加成
(5)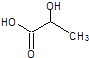 乳酸自酯化生成六元环状有机物
乳酸自酯化生成六元环状有机物
(6)军事工业生产TNT烈性炸药 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有Ca(OH)2 (固体)、CuSO4·5H2O (固体)、CH3COOH (液态)这些物质归为一类,下列哪些物质还可以和它们归为一类
A. 医用酒精 B. Fe(OH)3 胶体 C. 液态HCl D. 碱石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.CH2Cl2有 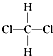 和
和 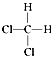 两种结构
两种结构
B.烯烃跟氢气起加成反应产物是2,2,3,4﹣四甲基戊烷,则这样的烯烃有3种
C.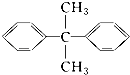 的一氯代物有5种
的一氯代物有5种
D.1 mol某烷烃完全燃烧消耗11 mol O2 , 则其主链上含有5个碳原子的同分异构体(不考虑空间异构)有6种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com