
| A、铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ |
| B、氢氧化钡溶液加入稀硫酸中:OH-+H+═H2O |
| C、石灰石加入稀盐酸中:CaCO3+2H+=Ca2++CO2↑+H2O |
| D、铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag |


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
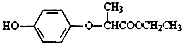 是一种合成农药所需的重要中间体.下列有关HPE的说法不正确的是( )
是一种合成农药所需的重要中间体.下列有关HPE的说法不正确的是( )| A、该有机物的分子式为C11H14O4 |
| B、该有机物具有7种不同化学环境的氢原子 |
| C、该有机物能与NaOH溶液反应,生成3种有机物 |
| D、1mol该有机物完全燃烧,将消耗12.5molO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子半径:N3->Na+>H+ |
| B、反应①和②都是氧化还原反应 |
| C、反应①和②氧化剂都是H2O |
| D、Na3N和NaH与盐酸反应都只生成一种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,3.36L氯气与2.7g铝充分反应转移的电子数小于0.3NA |
| B、标准状况下,5.6L O2作氧化剂时转移电子数一定为NA |
| C、0.1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA |
| D、80g CuO和Cu2S的混合物含有铜原子数一定为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol CO2 |
| B、标准状况下44.8 L H2 |
| C、3 NA 个水分子 |
| D、1 L 1 mol/L的硫酸钠溶液中所含的溶质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
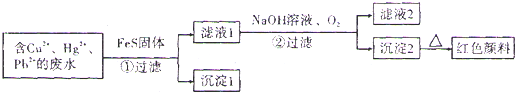
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com