
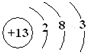 ,E为S,S有3层电子,最外层电子数为6,故处于第三周期第VIA族,故答案为:
,E为S,S有3层电子,最外层电子数为6,故处于第三周期第VIA族,故答案为: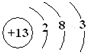 ;第三周期第VIA族;
;第三周期第VIA族;
| ||
| ||
| ||
| ||
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、航天飞机上的隔热陶瓷瓦属于复合材料 |
| B、水泥、陶瓷均为硅酸盐产品 |
| C、“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关 |
| D、化学反应能够制造出新的物质,同时也能制造出新的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl发生了氧化反应 |
| B、可用于海上照明供电 |
| C、若将镁换成铝,也可构成海水原电池 |
| D、电子由镁电极流出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、HClO的电子式: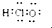 | ||
B、Mg2+的结构示意图: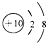 | ||
| C、乙酸乙酯的结构简式:CH3COOCCH3 | ||
D、具有16个质子,16个中子和18个电子的单核离子是
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、锌和硫酸反应:Zn+H2SO4═ZnSO4+H2 |
| B、碳酸钙和盐酸反应:CaCO3+2HCl═CaCl2+CO2+H2O |
| C、亚硫酸和双氧水反应:H2SO3+H2O2═H2SO4+H2O |
| D、铁和硫酸铜溶液反应:Fe+CuSO4═FeSO4+Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2+ NaOH=NaHCO3 | ||||
B、Fe2O3+3H2
| ||||
| C、Cu+2 FeCl3=2FeCl2+Cu | ||||
| D、2F2+2H2O=4HF+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ |
| B、氢氧化钡溶液加入稀硫酸中:OH-+H+═H2O |
| C、石灰石加入稀盐酸中:CaCO3+2H+=Ca2++CO2↑+H2O |
| D、铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
| B、Cl2通入NaOH溶液:Cl2+2OH-=Cl-+ClO-+H2O |
| C、AlCl3溶液中加入过量稀氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| D、将Na投入水中:2Na+2H2O=2Na++2OH-+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com