
【题目】下列有关化学用语正确的是( )
A. 氢氧根的电子式: ![]() H
H
B. 离子结构示意图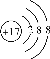 既可以表示35Cl-,也可以表示37Cl-
既可以表示35Cl-,也可以表示37Cl-
C. NH5的结构与NH4Cl相似,NH5的结构式: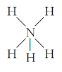
D. 丙烯的结构简式:C3H6
 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.某芳香烃的分子式为C10H14,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有3种
B.常压下,正戊烷、异戊烷、新戊烷的沸点依次降低
C.肌醇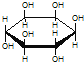 与葡萄糖
与葡萄糖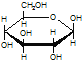 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物
的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物
D.1.0 mol的有机物(结构如图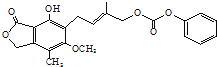 )最多能与含4.0molNaOH的水溶液完全反应
)最多能与含4.0molNaOH的水溶液完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,在水中存在沉淀溶解平衡:CdS(s)![]() Cd2+(aq)+S2-(aq),其溶度积Ksp=c(Cd2+)·c(S2-),其在水中的沉淀溶解平衡曲线如图所示(T2>T1)。下列说法错误的是( )
Cd2+(aq)+S2-(aq),其溶度积Ksp=c(Cd2+)·c(S2-),其在水中的沉淀溶解平衡曲线如图所示(T2>T1)。下列说法错误的是( )

A.图中a和b分别为T1、T2温度下CdS在水中的溶解度
B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W 原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层只有一个电子,Z的简单离子半径同周期中最小, W 的价电子数是Z的2倍。下列说法正确的是( )
A.第一电离能:W>Z>Y>X
B.由Y 、W组成的化合物的水溶液呈碱性的原因:W2-+2H2O![]() H2W+2OH-
H2W+2OH-
C.Z的最高价氧化物的水化物的碱性比Y的强
D.由 Z、W 组成的化合物不能在水溶液中制备
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

图1 图2 图3 图4
A. 图1表示0.1molMgCl2·6H2O在空气中充分加热时固体质量随时间的变化
B. 图2表示用0.1000 mol·LˉlNaOH溶液滴定25.00 mLCH3COOH的滴定曲线,则c(CH3COOH)=0.0800 mol·Lˉ1
C. 图3表示恒温恒容条件下,2NO2(g)![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
D. 图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则常温下,NaA溶液的pH小于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在![]() 的
的![]() ,溶液中有关粒子浓度由大到小的顺序为
,溶液中有关粒子浓度由大到小的顺序为![]() 。
。
(1)该溶液中![]() ________
________![]() (填“>”“=”或“<”),简述理由:_______________________________________________________________
(填“>”“=”或“<”),简述理由:_______________________________________________________________
(2)现向![]() 溶液中,逐滴加入少量含有酚酞的
溶液中,逐滴加入少量含有酚酞的![]() 溶液,可观察到的现象是__________________________________________________________;写出该反应的离子方程式:____________________________________。
溶液,可观察到的现象是__________________________________________________________;写出该反应的离子方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌—空气电池的电容量大,可作为汽车的清洁能源,总反应式为:2Zn + O2 + 2H2O=2Zn(OH)2,示意图如图所示。有关该电池的说法正确的是( )

A.电池可以用稀硫酸做电解质溶液
B.电池工作时,电子由a电极沿导线流向b电极
C.空气扩散电极上的电极反应:O2 + 2H2O + 4e– = 4OH–
D.阻隔空气进入锌—空气电池,电池仍能工作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用滴有酚酞和氯化钠溶液的湿润滤纸分别做甲、乙两个实验,下列判断正确的是

A. b、d两极附近均有气泡冒出
B. 甲乙中变红色的电极均发生了还原反应
C. a、d两极电极反应均为:Fe-2e-=Fe2+
D. 乙中铁棒比甲中铁棒更易腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经检测某工厂的酸性废水中所含离子及其浓度如下表所示:
离子 | Fe3+ | Cu2+ | SO42- | Na+ | H+ |
浓度/(mol/L) | 2×10-3 | 1×10-3 | 1×10-2 | 2×10-3 |
(1)c(H+)= mol/L。
(2)为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾(FeSO4·7H2O)。

① 工业废水中加入铁粉后,反应的离子方程式为:
Fe + Cu2+ == Fe2+ + Cu、 、 。
② 试剂B是 。
③ 操作③是蒸发浓缩、冷却结晶、 ,最后用少量冷水洗涤晶体,在低温下干燥。
④ 通过检验溶液D中Fe3+来判断废水中Fe3+是否除尽,实验方法是 。
⑤ 获得的FeSO4·7H2O需密闭保存,原因是 。
⑥ 上述1000 L废水经处理,可获得 FeSO4·7H2O的物质的量是 mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com