
【题目】短周期主族元素X、Y、Z、W 原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层只有一个电子,Z的简单离子半径同周期中最小, W 的价电子数是Z的2倍。下列说法正确的是( )
A.第一电离能:W>Z>Y>X
B.由Y 、W组成的化合物的水溶液呈碱性的原因:W2-+2H2O![]() H2W+2OH-
H2W+2OH-
C.Z的最高价氧化物的水化物的碱性比Y的强
D.由 Z、W 组成的化合物不能在水溶液中制备
【答案】D
【解析】
短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,则X是O元素;Y原子的最外层只有一个电子,则Y是Na元素;Z的简单离子半径同周期中最小,则Z是Al元素;W 的价电子数是Al的2倍为6,则W是S元素。
A项、元素的金属性越强,第一电离能越小,元素的非金属性越强,第一电离能越大,则第一电离能: X(O)> W(S)>Z(Al)>Y(Na),故A错误;
B项、硫化钠为强碱弱酸盐,硫离子在溶液中分步水解,水解的离子方程式为S2-+H2O![]() HS—+OH—,故B错误;
HS—+OH—,故B错误;
C项、元素的金属性越强,最高价氧化物的水化物的碱性越强,金属性钠元素强于铝元素,则钠的最高价氧化物的水化物的碱性比铝的强,故C错误;
D项、铝离子和硫离子在溶液中发生双水解反应生成氢氧化铝和硫化氢,则不能在水溶液中制备硫化铝,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】新鲜水果、蔬菜、乳制品中富含的维生素C,具有明显的抗衰老作用,但易被空气氧化.某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下:
下列说法正确的是( )
A. 上述反应为取代反应
B. 维生素C不可溶于水,可溶于有机溶剂
C. 维生素C在酸性条件下水解只得到1种产物
D. 脱氢维生素C的分子式为C6H8O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如图所示(电极未标出)。回答下列有关问题:
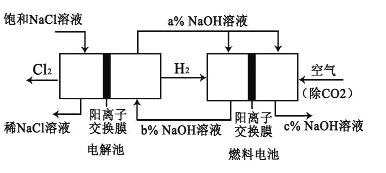
(1)电解池的阴极反应式为_____________。
(2)通入空气一极的电极反应式为_____________。燃料电池中阳离子的移动方向是_____________ (“从左向右”或“从右向左”)。
(3)电解池中产生 2molCl2,理论上燃料电池中消耗标准状况下_____________LO2。
(4) a、b、c 由大到小的顺序为:_____________。
(5)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,可由 KClO3在H2SO4存在下与 Na2SO3反应制得。请写出反应的离子方程式_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同物质的量浓度的 HC1 溶液,分别滴定物质的量浓度均为 0.1 mol/L 的三种碱溶液,滴定 曲线如图所示。下列判断正确的是

A. 滴定前,三种碱溶液中水电离出的 c(H+)大小关系: DOH>BOH>AOH
B. pH= 7 时,c(A+)=c(B+)=c(D+)
C. 滴定至 P 点时,溶液中:c(Cl-)>c(B+)>c(BOH)>c(OH-)>c(H+)
D. 当中和百分数达 100%时,将三种溶液混合后:c(AOH)+c(BOH)+c(DOH)=c(H+)-c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,在H2C2O4、NaOH混合溶液中,c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol/L。含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。下列说法正确的是( )
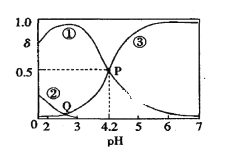
A. ①表示H2C2O4的分布曲线,③表示C2O42-的分布曲线
B. 20℃时,H2C2O4的二级电离平衡常数Ka2=1×10-4.2
C. Q点对应溶液中lgc(H+)<lgc(OH-)
D. 0.100mol·L-1的NaHC2O4溶液中:c(OH-)=c(H+)-2c(C2O42-)+c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将0.1 mol/L的NaOH溶液滴入盛有50 mLpH=2 的HA溶液的绝热容器中,加入NaOH溶液的体积V与溶液温度T的关系如图。下列说法正确的是( )

A.a点溶液中,c(A-)+c(HA)=0.08 mol/L
B.b点溶液中,c(A-)<c(Na+)
C.a→b的过程中,发生了吸热反应
D.溶液中HA的电离平衡常数a点等于b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语正确的是( )
A. 氢氧根的电子式: ![]() H
H
B. 离子结构示意图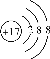 既可以表示35Cl-,也可以表示37Cl-
既可以表示35Cl-,也可以表示37Cl-
C. NH5的结构与NH4Cl相似,NH5的结构式: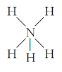
D. 丙烯的结构简式:C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是![]()
A. 如图表示同温度下,
如图表示同温度下,![]() 的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B. 如图表示
如图表示![]()
![]() 溶液滴定
溶液滴定![]()
![]()
![]() 溶液所得到的滴定曲线
溶液所得到的滴定曲线
C. 如图表示压强对可逆反应
如图表示压强对可逆反应![]() 的影响,乙的压强比甲的压强大
的影响,乙的压强比甲的压强大
D. 如图若除去
如图若除去![]() 溶液中的
溶液中的![]() 可向溶液中加入适量CuO至pH在4左右
可向溶液中加入适量CuO至pH在4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂对制革工业污泥中铬的处理工艺流程如下:
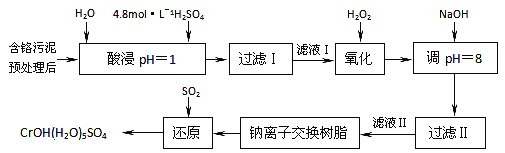
已知硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)酸浸时,为了提高浸取率可采取的措施有_________、___________。(答出两点)。
(2)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — |
沉淀完全时的pH | 3.7 | 5.4(>8溶解) | 9(>9溶解) |
①用NaOH调节溶液的pH不能超过8,其理由是________________________________。
②常温下,当pH=8时,Mg2+是否开始沉淀(溶液中镁离子浓度不超过1mol·L-1)___________ 。 (填“是”或“否”)若要使Mg2+完全沉淀,溶液的pH至少为_________(已知Ksp[Mg(OH)2]=1. 6×10-12,lg2=0.3)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com