
【题目】下列图示与对应的叙述相符的是

图1 图2 图3 图4
A. 图1表示0.1molMgCl2·6H2O在空气中充分加热时固体质量随时间的变化
B. 图2表示用0.1000 mol·LˉlNaOH溶液滴定25.00 mLCH3COOH的滴定曲线,则c(CH3COOH)=0.0800 mol·Lˉ1
C. 图3表示恒温恒容条件下,2NO2(g)![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
D. 图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则常温下,NaA溶液的pH小于同浓度的NaB溶液的pH
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A.漂白粉溶液中通入过量的CO2:Ca2+ +2ClO- + CO2 +H2O = CaCO3↓+2HClO
B.实验室用MnO2和浓盐酸制取Cl2:MnO2 + 4HCl(浓)![]() Mn2+ +2Cl- + Cl2↑ + 2H2O
Mn2+ +2Cl- + Cl2↑ + 2H2O
C.NaHCO3溶液中加足量Ba(OH)2溶液:HCO3- + Ba2+ + OH-= BaCO3↓+ H2O
D.钠和冷水反应:Na + 2H2O = Na+ + H2↑+ 2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组探究SO2与FeCl3溶液的反应,装置如下图所示。
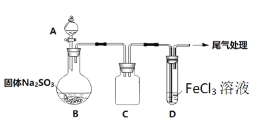
已知:
i.Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。
ii.生成Fe(HSO3)2+离子的反应为:Fe3+ +HSO![]() Fe(HSO3)2+ 。
Fe(HSO3)2+ 。
步骤一:实验准备:
如上图连接装置,并配制100mL 1.0 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管D 中。
(1)配制100mL1.0 mol·L-1 FeCl3溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和______,装置C的作用为:________________。
(2)用离子方程式解释1.0 mol·L-1 FeCl3溶液(未用盐酸酸化)pH=1的原因:________
步骤二:预测实验
(3)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色。
该小组同学预测的理论依据为:________________
步骤三:动手实验
(4)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,将混合液放置12小时,溶液才变成浅绿色。
①SO2与FeCl3溶液反应生成了Fe(HSO3)2+离子的实验证据为:__________。证明浅绿色溶液中含有Fe2+的实验操作为:_____________ 。
②为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了如下实验。
实验I | 往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色。 |
实验II | 往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
综合上述实验探究过程,得出的结论为:____________。
步骤四:反思实验:
(5)在制备SO2的过程中,同学们发现,使用70%的硫酸比用98%的浓硫酸反应速率快,分析其中的原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定稳定下,在容积不变的密闭容器中,进行如下可逆反应:![]() ,下列能表明该反应已达到平衡状态的是
,下列能表明该反应已达到平衡状态的是
①![]()
②![]()
③![]()
④混合气的密度保持不变
⑤混合气体的平均摩尔质量不变
A.仅④B.仅④⑤
C.仅①④D.仅③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
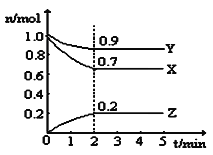
(1)该反应的化学方程式为______。
(2)反应开始至2min,以气体Z表示的平均反应速率为______。平衡时X的转化率为______。
(3)2min反应达到平衡,容器内混合气体的平均相对分子质量比起始时______![]() 填“大”、“小”或“相等”,下同
填“大”、“小”或“相等”,下同![]() ,混合气体密度比起始时______。
,混合气体密度比起始时______。
(4)下列叙述能证明该反应已经达到化学平衡状态的是![]() 填序号
填序号![]() ______。
______。
A.Y的体积分数不再变化 B.容器内气体压强不再变化
C.υ(X) :υ(Y) =3:1 D.单位时间内消耗3nmol X同时生成2nmol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了酸性高锰酸钾与草酸的反应,记录以下实验数据(已知![]() 为阿伏伽德罗常数的值):
为阿伏伽德罗常数的值):
试管中所加试剂及其用量/mL | 溶液退至无色所需时间/min | |||||
实验编号 | 实验温度/℃ | 0.6 mol/LH2C2O4溶液 | H2O | 3 mol/LH2SO4溶液 | 0.05 mol/LKMnO4溶液 | |
① | 25 | 3.0 | v1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | v2 | 2.0 | 3.0 | 1.0 |
(1)请写出该反应的离子方程式:___,当该反应以实验①中数据反应完全时转移电子数为_____![]() 。
。
(2)实验①②是探究浓度对反应速率的影响,实验②③时探究温度对反应速率的影响,则表中V1=_______,V2=__________。
(3)根据实验①、②的数据,可以得到的结论是____。
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。

该小组同学根据上述信息提出了新的假设,并设计一下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量/ml | 再加入某种固体 | 溶液退至无色所需时间/min | |||
0.6 mol/LH2C2O4溶液 | H2O | 3 mol/LH2SO4溶液 | 0.05 mol/L KMnO4 溶液 | ||||
④ | 25 | 3.0 | 2.0 | 2.0 | 3.0 | MnSO4 | t |
①该小组同学提出的新假设是__________。
②若该小组同学提出的假设成立,应观察到__________(填实验现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )

A. 三种酸的电离常数关系:KHA>KHB>KHD
B. 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为氯碱工业的简易装置示意图,其中两电极均为惰性电极,下列说法正确的是
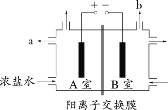
A.粗盐水中含有的少量 Ca2+和 Mg2+均可用 NaOH 除去
B.若电路中通过 0.2 mol 电子,理论上可在 b 处得到标准状况下 1.12 L 气体
C.a 处得到的是浓 NaOH 溶液
D.适当降低阳极电解液的 pH 有利于 Cl2 逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是一种无色有刺激性气味的液体,在生活中有重要用途,同时也是一种重要的化工原料。
(1)甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气、KOH溶液(电解质溶液)构成,则下列说法正确的是___。
(已知甲醇在空气中燃烧生成CO2和H2O)
A.电池放电时通入空气的电极为负极
B.电池放电时负极的电极反应式为CH3OH-6e-=CO2↑+2H2O
C.电池放电时,电解质溶液的碱性逐渐减弱
D.电池放电时每消耗6.4gCH3OH转移1.2mol电子
(2)写出甲醇燃料电池在酸性条件下负极的电极反应式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com