
【题目】下列物质属于电解质的是( )
A.AgB.NaCl溶液C.蔗糖D.KOH
科目:高中化学 来源: 题型:
【题目】SO2通过下列工艺流程可制备化工原料H2SO4和清洁能源H2
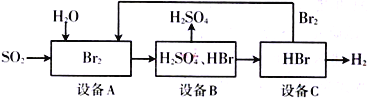
下列说法中不正确的是
A. 设备A中的溴水褪色,体现了SO2的还原性
B. 该生产工艺的优点:Br2可以循环利用,并获得清洁能源H2
C. 该工艺流程的总反应方程式为:SO2+Br2+2H2O=H2SO4+2HBr
D. 设备C中是否残余H2SO4,可在C的样品溶液中加入BaCl2溶液,观察是否有沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 可逆反应中逆反应的活化能减去正反应的活化能就是此反应的ΔH
B. 反应物的总能量减去生成物的总能量就是此反应的ΔH
C. 反应物的总键能减去生成物的总键能就是此反应的ΔH
D. 常温下:H2+Cl2![]() 2HCl K=5.3×1033;H2+Br2
2HCl K=5.3×1033;H2+Br2 ![]() 2HBr K=2.2×1018,可判断非金属性:Br>Cl
2HBr K=2.2×1018,可判断非金属性:Br>Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲从Fe3+、Al3+的混合液中分离并测定Fe3+的浓度,实验方案如下:

已知:①乙醚[(C2H5)2O]:沸点34.5℃,微溶于水,易燃。
②盐酸浓度较高时,Fe3+与HCl、乙醚形成化合物[(C2H5)2OH][FeCl4]溶于乙醚;当盐酸浓度降低时,该化合物解离。
(1)操作I的名称是_______。
(2)检验溶液Y中是否残留Fe3+的实验方法是_________ 。
(3)蒸馏装置如下图所示,该装置图中存在的错误是________。

(4)滴定前,加入的适量溶液Z是_______(填序号)。
A.H2SO4~H3PO4 B.H2SO3~H3PO4 C.HNO3~H3PO4 D.HI~H3PO4
(5)滴定达到终点时,消耗0.1000mol/LK2Cr2O7溶液5.00mL。根据该实验数据,起始所取的试样Fe3+、Al3+的混合液中c(Fe3+)为______。
(6)上述测定结果存在一定的误差,为提高该滴定结果的精密度和准确度,可采取的措施是_______。
A.稀释被测试样 B.增加平行测定次数
C.减少被测试样取量 D.降低滴定剂浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向 0.1mol/LNa2A溶液中不断通入HCl。H2A、HA-、A2-在溶液中所占物质的量分数与 pOH[pOH=-lgc(OH-)]的关系如图所示,下列说法正确的是( )
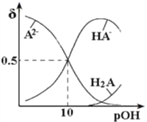
A. H2A的第二级电离平衡常数为10-10
B. 随着HCl的通入 c(H+)/c(H2A)先减小后增大
C. 当溶液呈中性时:c(Na+)=c(HA-)+2c(A2-)
D. 将等浓度等体积的 Na2A与H2A溶液混合后,溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】飘尘是物质燃烧时产生的粒状漂浮物,颗粒很小,不易沉降,它与空气中的SO2和O2接触时,SO2会部分转化为SO3,使空气的酸度增加,飘尘所起的作用可能是
A. 氧化剂 B. 还原剂 C. 催化剂 D. 载体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图表示的反应关系中,部分产物被略去。已知2 mol白色固体粉末X受热分解,恢复到室温生成白色固体A、无色液体B和无色气体C各1 mol。X、E、G的焰色反应均为黄色。

回答下列问题:
(1)写出下列物质的化学式:G________,D________。
(2)写出G与C反应生成D的化学反应方程式:____________________________。
(3)写出X+E→A的离子方程式:______________________________________。
(4)写出C与Na2O2反应的化学方程式:_____________________________。若有0.2 mol Na2O2参加反应,则转移的电子数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把碎纸片b补充到a中,可得到一个完整的离子方程式(未配平)。下列说法正确的是( )

A. 反应物微粒是S、SO![]() 、OH-
、OH-
B. 该反应可能在酸性条件下进行
C. 氧化剂与还原剂的物质的量之比为2∶1
D. 2 mol S参加反应时,转移的电子数为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com