
【题目】下列气体中,既能用浓硫酸干燥,又能用NaOH固体干燥的是( )
A.CH4B.NH3C.HClD.SO2
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】纯碱(Na2CO3)在生产生活中具有广泛的用途。
Ⅰ.以下是实验室模拟制碱原理制取Na2CO3的流程图。
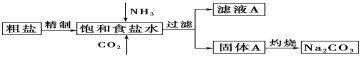
下表是四种物质在100g水中不同温度的溶解度

(1)粗盐中含有的杂质离子有Ca2+、Mg2+、SO42-等。精制除杂的步骤顺序是a→________→________→________→b(填字母编号)。
a.粗盐溶解,滤去沉渣 b.加入盐酸调pH c.加入Ba(OH)2溶液
d.加入Na2CO3溶液 e.过滤
(2)向饱和食盐水中先通入_______,后通入________,生成固体A的化学方程式为____
Ⅱ.制得的碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案.请回答下列有关问题:
方案一:把6g样品溶解后加入过量的CaCl2溶液,将所得沉淀过滤、洗涤、烘干后得到5g固体。
(3)洗涤沉淀的具体操作是_____________________________。
(4)根据实验中测得的有关数据,计算纯碱样品Na2CO3的质量分数为___________(结果保留小数点后一位)。
方案二:利用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去)。
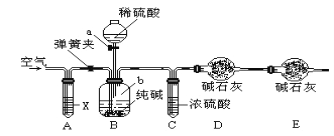
已知:碱石灰为氢氧化钠和氧化钙的混合物。
(5)实验开始前应进行的操作是______________________________。
(6)仪器a的名称为___________________,装置A中试剂X应选用_________________。
(7)装置E的作用是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2的含量是衡最大气污染的一个重要指标,工业上常采用催化还原法或吸收法处理SO2。利用催化还原SO2不仅可消除SO2污染,而且可得到有经济价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和H2O。
己知CH4和S的燃烧热(△H)分别为-890.3k/mol和-297.2kJ/mol,则CH4和SO2反应的热化学方程式为_____________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
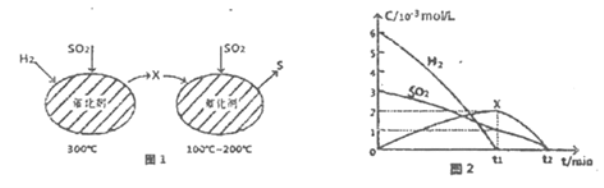
①分析可知X为______(写化学式),0~t1时间段的温度为_____,0~t1时间段用SOz表示的化学反应速率为________。
②总反应的化学方程式为_____________。
(3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容容器中,1mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容容器中,1mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。

①该反应的△H____0(填“>”或“<”)
②算a点的平衡常数为_________。
(4)工业上可用Na2SO3溶液吸收法处理SO2,25℃时用1mo/L的Na2SO3溶液吸收SO2。当溶液pH=7时,溶液中各离子浓度的大小关系为________。已知:H2SO3的电离常数K1=1.3×10-2,K2=6.2×10-8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小龙同学在实验室选用碘量法测定某磁铁矿(主要成分是 Fe3O4,杂质SiO2、CuO)中铁元素质量分数,实验步骤如下:
①酸浸:取样m g,先将矿石粉碎,加入足量2mol/LH2SO4浸取,过滤后得到浸取液;
②除杂:先向浸取液中加入足量 H2S溶液,过滤后加入足量酸性 H2O2溶液氧化Fe2+(过量的H2S转化为S),再加入一定量MnO2固体除去过量的H2O2,一段时间后过滤得到Vml 滤液;
③定容:将滤液稀释至250mL,取出25.00mL于带塞子的锥形瓶中待用;
④转化:向25.00mL溶液中加入足量KI固体,塞上塞子于暗处静置30min;
⑤滴定:加入指示剂后,用cmol/LNa2S2O3标准溶液进行滴定至终点,消耗Na2S2O3标准溶液 V1mL;
⑥重复④⑤操作2次。 已知:2S2O32-+I2==S4O62-+2I-
1)①中将矿石粉碎的目的是____________________________________________,加入足量 H2SO4的目的是__________________________________。
2)写出②中加入足量 H2S 溶液发生反应的离子反应方程式:_____________________________。
3)③中用______________________________ _(填仪器名称)取出 25.00mL 溶液。
4)⑤中加入的指示剂是________,滴定终点的现象是:滴入最后一滴 Na2S2O3标准溶液 后,__________。⑥中重复进行实验的目的是______。
5)该磁铁矿中铁元素质量分数为______________(用含 m、c、V1的代数式表示,需要化简)。
6)若滴定过程中溶液 pH 过低则会导致测定结果______ (填“偏高”、“偏低”),写出 导致这种误差的离子反应方程式___________。
若②中过量的 H2O2溶液没除则会导致测定结果_____(填“偏高”、“偏低”) 若②中 MnO2固体没有过滤除去则会导致测定结果_________(填“偏高”、“偏低”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置进行有关Cl2的实验。下列说法不正确的是


A. Ⅰ图中:实验现象证明氯气无漂白作用,氯水有漂白作用
B. Ⅱ图中:闻Cl2的气味
C. Ⅲ图中:生成棕黄色的烟
D. Ⅳ图中:若气球干瘪,证明Cl2可与NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了减少大气污染,许多城市推广汽车使用清洁燃料,目前使用的清洁燃料主要有两类:一类是压缩天然气,一类是液化石油气。这类燃料的主要成分都是
A. 碳水化合物 B. 碳氢化合物 C. 氢气 D. 醇类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向三种浓度相同的弱酸HX、HY、HZ中分别滴加相同浓度的NaOH溶液,溶液pH与中和百分数变化曲线如图所示,下列判断不正确的是

A. 三种酸的电离常数关系:Ka(HX)>Ka(HY)>Ka(HZ)
B. 图中A点时溶液中离子浓度大小关系:c(Y-)>c(Na+)>c(HY)>c(H+)>c(OH-)
C. pH=7时,三种溶液中:c(X-)=c(Y-)=c(Z-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HX)+c(HY)+c(HZ)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有一定量浓硝酸的试管中加入6.4 g铜片发生反应。请回答:
(1)开始阶段,观察到的现象为________________,反应的化学方程式是_____________。
(2)反应结束后,铜片有剩余,再加入少量20%的稀硫酸,这时铜片上又有气泡产生,反应的离子方程式是__________________。
(3)若6.4 g铜片消耗完时,共产生气体2.8 L(标准状况)。则整个反应过程中所消耗的硝酸的物质的量是_____________。
(4)实验室中硝酸通常保存在棕色试剂瓶中,原因是_____________(用化学方程式表示)。
(5)工业上通常用氨催化氧化法制硝酸,写出氨催化氧化的化学方程式:_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com