
【题目】下列叙述中正确的是( )
A.体积相同、浓度均为0.1 mol?L﹣1的NaOH溶液、氨水,分别稀释m倍、n倍,溶液的pH都变成9,则m<n
B.有甲、乙两氨水溶液,测得甲的pH=a,乙的pH=a+1,则甲乙两溶液c(H+)之比为10:1
C.相同温度下,0.2 mol?L﹣1乙酸溶液与0.1 mol?L﹣1乙酸溶液中c(H+)之比为2:1
D.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,K= ![]() .若加入少量醋酸钠固体,则CH3COOH?CH3COO﹣+H+向左移动,α减小,K变小
.若加入少量醋酸钠固体,则CH3COOH?CH3COO﹣+H+向左移动,α减小,K变小
【答案】B
【解析】解:A、氢氧化钠是强电解质完全电离,一水合氨是弱电解质,在水溶液里部分电离,相同浓度的两种溶液中,氢氧化钠溶液的pH大于氨水,加水稀释促进一水合氨电离,但一水合氨仍然存在电离平衡,电离程度仍然小于氢氧化钠,所以要使稀释后溶液的PH相等,则氢氧化钠需要稀释倍数大于氨水,即m>n,故A错误;
B、c(H+)=10﹣pH , 故pH=a的氨水溶液中氢离子浓度为10﹣amol/L,pH=a+1的乙酸溶液中的氢离子浓度为10﹣(a+1)mol/L,故甲乙两溶液c(H+)之比为10:1,故B正确;
C、醋酸是弱酸,越稀越电离,故0.2 molL﹣1乙酸溶液的电离程度小于0.1 molL﹣1乙酸溶液的电离程度,故c(H+)之比小于2:1,故C错误;
D、弱电解质的电离平衡常数只与温度有关,温度不变是,醋酸的电离平衡常数不变,但稀释醋酸溶液时促进醋酸电离,导致醋酸的电离度增大,故D错误.
故选B.


科目:高中化学 来源: 题型:
【题目】
(1)苯、四氯化碳、乙醇、汽油是常见的有机溶剂,能与水互溶的是 , 不溶于水,且密度比水小的是。
(2)写出下列反应的化学方程式并注明反应类型
① 用乙烷制备氯乙烷(C2H5Cl) , ;
② 乙烯与水反应制乙醇 , ;
③ 苯制取溴苯 , 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体X是由两种常见元素组成的化合物,其中金属元素与另一元素的质量比为14:1。在一定条件下X可发生如图的转化关系,有的反应标出全部产物,有的反应标出部分产物。已知P为气体混合物,R是一种无色无味能使澄清石灰水变浑浊的气体,C为红褐色沉淀,M为一种常见金属单质。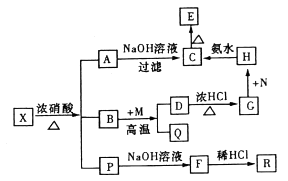
试回答下列问题:
(1)X的化学式为。
(2)实现G→H,欲不引进新的杂质,N可以选择下列物质中的(填序号)。
①KMnO4 ②HNO3 ③H2O2 ④Cl2
(3)写出下列转化的化学方程式:
B→D:;H→C:。
(4)已知P中有一种气体与氢氧化钠溶液反应可生成两种正盐,该反应的离子方程式为:。
(5)X与浓硝酸在一定条件下反应时,若有1 mol X被氧化时,转移的电子数目为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、C原子都有两个未成对的单电子,D的二价阳离子与C的阴离子具有相同的电子层结构. B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 .
(2)B的氢化物的分子空间构型是 , 其中心原子的杂化方式是 .
(3)AC2的电子式 , 是分子(填“极性”或“非极性”),一种由B、C组成的化合物与AC2互为等电子体,其化学式为
(4)E的核外电子排布式是 , ECl3与B、C的氢化物形成的配合物的化学式为 .
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表中横行的编排依据是( )
A. 按元素的相对原子质量递增顺序从左到右排列
B. 按元素的原子核外电子层数依次递增顺序从左到右排列
C. 电子层相同的元素,按原子序数依次递增顺序从左到右排列
D. 按元素的原子最外层电子数依次递增顺序从左到右排列
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:3CH4(g)+2N2(g)3C(s)+4NH3(g)△H>0,700℃时,CH4与N2在不同物质的量之比[ ![]() ]时CH4的平衡转化率如图所示.下列说法正确的是( )
]时CH4的平衡转化率如图所示.下列说法正确的是( ) 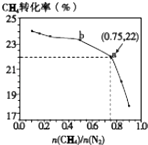
A.![]() 越大,CH4的转化率越高
越大,CH4的转化率越高
B.![]() 不变时,若升温,NH3的体积分数会增大
不变时,若升温,NH3的体积分数会增大
C.b点对应的平衡常数比a点的大
D.a点对应的NH3的体积分数约为26%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜的制备实验是化学实验教学中一个必做实验,某学习小组设计了如下两个实验方案:
(1)实验一:
因铜不能与稀硫酸反应,实验中用铜和浓硫酸加热使之完全反应,将溶液通过蒸发、结晶等操作得到硫酸铜晶体。
根据上述实验和反应,比较浓硫酸与稀硫酸的性质,浓硫酸具有。
(2)该反应的化学方程式为。
(3)实验二:
以空气为氧化剂的一步氧化法,将空气或氧气直接通入到铜粉与稀硫酸的混合物中,其反应原理为2Cu + O2 + 2H2SO4 = 2CuSO4 + 2H2O ,但反应速率太慢,当升高温度到80~90℃,反应仍然缓慢。如在铜粉和稀硫酸的混合物中加入少量Fe2(SO4)3溶液,则速率明显加快。
Fe2(SO4)3的作用是。
(4)得到的混合液可以用下列四种物质中的调节溶液的pH =2~4,使Fe3+ 形成Fe(OH)3沉淀而除去:
A.NaOH
B.CuO
C. CuCO3
D.Fe
(5)请根据以上内容,对这两个实验方案进行评价,填下表:
实 验 (一) | 实 验 (二) | |
主要优点 | 操作简便 | ⑴原料充分转化为产品 |
主要缺点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验安全问题的叙述中正确的是
A. 凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂
B. 大量氯气泄漏时,迅速离开现场并尽量往低处去
C. 做实验剩余的金属钠应放回原试剂瓶中
D. 配制稀硫酸时,将水缓慢倒入浓硫酸中并不断搅拌
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com