
����Ŀ������X�������ֳ���Ԫ����ɵĻ�������н���Ԫ������һԪ�ص�������Ϊ14��1����һ��������X�ɷ�����ͼ��ת����ϵ���еķ�Ӧ���ȫ������еķ�Ӧ������ֲ����֪PΪ�������R��һ����ɫ��ζ��ʹ����ʯ��ˮ����ǵ����壬CΪ���ɫ������MΪһ�ֳ����������ʡ�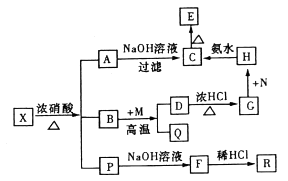
�Իش��������⣺
��1��X�Ļ�ѧʽΪ��
��2��ʵ��G��H�����������µ����ʣ�N����ѡ�����������е�������ţ���
��KMnO4 ��HNO3 ��H2O2 ��Cl2
��3��д������ת���Ļ�ѧ����ʽ��
B��D:��H��C����
��4����֪P����һ������������������Һ��Ӧ�������������Σ��÷�Ӧ�����ӷ���ʽΪ����
��5��X��Ũ������һ�������·�Ӧʱ������1 mol X������ʱ��ת�Ƶĵ�����ĿΪ��
���𰸡�
��1��Fe3C
��2���ۢ�
��3��3Fe+4H2O(g) ![]() Fe3O4 +4H2,3NH3��H2O +FeC13=Fe(OH)3��+3NH4Cl
Fe3O4 +4H2,3NH3��H2O +FeC13=Fe(OH)3��+3NH4Cl
��4��2NO2+2OH-=NO2-+NO3-+H2O
��5��13NA
�������������������ת����ϵ��R����ɫ��������ʹ����ʯ��ˮ����ǵ����壬�ж�ΪCO2����FӦΪ̼���Σ���P��Ӧ����̼Ԫ�أ�CΪ���ɫ����ΪFe��OH��3����A��H�ж����������ӣ�����AΪFe��NO3��3������X�������ֳ���Ԫ����ɵĻ�����ж�һ��������Ԫ�غ�̼Ԫ�أ����н���Ԫ������һԪ�ص�������Ϊ14��1����X��ѧʽΪFe3C������Ԫ���غ㣬B��Ӧ������Ԫ�أ�������MΪ�����������ʣ���B��Ӧ����Q��D������BΪH2O��QΪH2��H������Ԫ���жϣ�MΪ����Fe��DΪFe3O4��D�����ᷴӦ����GΪFeCl2��FeCl3��NΪCl2��G��N��Ӧ����HΪFeCl3��C��������EΪFe2O3��X��Ũ���ᷴӦ���ɻ������PӦΪCO2��NO2��
��1����������ķ�����֪��X�Ļ�ѧʽΪFe3C��
���Դ��ǣ�Fe3C��
��2��ʵ��FeCl2��FeCl3�����������µ����ʣ�N������H2O2��Cl2��
��ѡ�ۢܣ�
��3��MΪ����Fe��ˮ�����ڸ��·�Ӧ�Ļ�ѧ����ʽΪ3Fe+4H2O ![]() Fe3O4+4H2���Ȼ����백ˮ��Ӧ��������������������Ӧ�Ļ�ѧ����ʽΪ3NH3��H2O +FeC13=Fe(OH)3��+3NH4Cl ��
Fe3O4+4H2���Ȼ����백ˮ��Ӧ��������������������Ӧ�Ļ�ѧ����ʽΪ3NH3��H2O +FeC13=Fe(OH)3��+3NH4Cl ��
���Դ��ǣ�3Fe+4H2O ![]() Fe3O4+4H2��3NH3��H2O +FeC13=Fe(OH)3��+3NH4Cl��
Fe3O4+4H2��3NH3��H2O +FeC13=Fe(OH)3��+3NH4Cl��
��4��PΪCO2��NO2��P����һ������������������Һ��Ӧ�������������Σ���÷�ӦΪ�����������������Ʒ�Ӧ���������ƺ��������ƣ���Ӧ�����ӷ���ʽΪ2NO2+2OH-=NO2-+NO3-+H2O��
���Դ��ǣ�2NO2+2OH-=NO2-+NO3-+H2O��
(5) XΪFe3C����Ũ������һ�������·�Ӧʱ�������������Ͷ�����̼����1 mol Fe3C������ʱ��������Ԫ�صĻ��ϼ�Ϊ0�ۣ���Ӧ������0�۱��+3�ۣ�C��0�۱��+4�ۣ�ת�Ƶĵ��ӵ����ʵ���Ϊ3��3+4=14mol����ĿΪ13NA��
���Դ��ǣ�13NA��


 ͨ��ѧ��Ĭд����ϵ�д�
ͨ��ѧ��Ĭд����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����п��1mol/Lϡ������Һ��ȡ�������������ȡ���������ʣ����д�ʩ�����е��ǣ� ��
A.����98%��Ũ����
B.ʹ�ø�С������п��
C.��������CuSO4��Һ
D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������������Һ�����廯����Һ����ˮ�Ļ��Һ���������ǵ���ȷ����������(����)
A. ��Һ������B. ��ȡ����Һ
C. ��Һ����ȡD. ����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���ᡢ��ˮ���ܶ�������ˮ���Ĺ�ϵ��ͼ��ʾ�����������백ˮ��һ�ݣ�����ݱ�����Ϣ���ش���������:
��1�������������������W1Ϊ(��д��λ���ú�c1��p1�Ĵ���ʽ��ʾ)��
��2�����ʵ���Ũ��Ϊc1mol�� L-1��������Ϊw1��������ˮ��������(��Ϻ���Һ����仯���Բ���)��������Һ�����ʵ���Ũ��Ϊ mol�� L-1 �� ��������w1/2(����ڡ�����С�ڡ����ڡ�����ͬ)��
��3����������Ϊw2�İ�ˮ��w2/5�İ�ˮ��������ϣ�������Һ���ܶ� ![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���������ӻ�ԭ��ǿ��˳��ΪF����Cl����Br����I����S2����ij��Һ������ͬŨ�ȵ�F����Cl����Br����I����S2��������������μ������Ƶı�����ˮֱ������ʱ����������������� �� ��
A.Br��B.Cl��C.F��D.S2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ʈ��������ȼ��ʱ��������״Ư���������С�����׳� ������������е�SO2��O2�Ӵ�ʱ��SO2�Ჿ��ת��ΪSO3 �� ʹ������������ӣ�Ʈ����������ÿ�����( )
A.������
B.��ԭ��
C.����
D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ����Ʒ����������
A. ��ȥCO2�����л��е�HCl������̼��������Һ
B. ������CCl4�Ļ�����Һ
C. ����NaCl��KCl��Һ����ɫ��Ӧ
D. ����ijδ֪��Һ�е�SO42-������ϡ�����ữ��BaCl2��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ���ǣ� ��
A.�����ͬ��Ũ�Ⱦ�Ϊ0.1 mol?L��1��NaOH��Һ����ˮ���ֱ�ϡ��m����n������Һ��pH�����9����m��n
B.�мס�������ˮ��Һ����ü�pH=a���ҵ�pH=a+1�����������Һc��H+��֮��Ϊ10��1
C.��ͬ�¶��£�0.2 mol?L��1������Һ��0.1 mol?L��1������Һ��c��H+��֮��Ϊ2��1
D.��֪һ���¶��£�������Һ�����ʵ���Ũ��Ϊc�������Ϊ����K= ![]() �����������������ƹ��壬��CH3COOH?CH3COO��+H+�����ƶ�������С��K��С
�����������������ƹ��壬��CH3COOH?CH3COO��+H+�����ƶ�������С��K��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����14�֣�H2S��SO2��Ի��������彡�����������Σ������ҵ�ϲ�ȡ���ַ���������Щ�к�������ŷţ��ش����з����е����⡣ ��H2S�ij�ȥ
����1��������H2S��ԭ��Ϊ��
H2S+Fe2(SO4)3![]() S��+2FeSO4+H2SO4
S��+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
��1����˾�����ʱ��FeSO4����������������ʱ��5��105�����þ�����������
��2����ͼ3��ͼ4�ж�ʹ����˾����������Ϊ������Ӧ�¶ȹ��ߣ���Ӧ�����½�����ԭ������ 
��3������2����һ�������£���H2O2����H2S ���Ųμӷ�Ӧ��n(H2O2)/n(H2S)�仯���������ﲻͬ����n(H2O2)/n(H2S)=4ʱ����������ķ���ʽΪ��
��4����SO2�ij�ȥ ����1��˫�������NaOH����SO2 �� ����CaOʹNaOH����
NaOH��Һ ![]() Na2SO3
Na2SO3
д�����̢ٵ����ӷ���ʽ����CaO��ˮ�д�������ת����
CaO(s)+H2O (l) ![]() Ca(OH)2(s)
Ca(OH)2(s) ![]() Ca2+(aq)+2OH(aq)
Ca2+(aq)+2OH(aq)
��ƽ���ƶ��ĽǶȣ��������̢�NaOH������ԭ����
��5������2���ð�ˮ��ȥSO2��֪25�棬NH3��H2O��Kb=1.8��105 �� H2SO3��Ka1=1.3��102 �� Ka2=6.2��108������ˮ��Ũ��Ϊ2.0 mol��L-1 �� ��Һ�е�c(OH)=mol��L1����SO2ͨ��ð�ˮ�У���c(OH)����1.0��107 mol��L1ʱ����Һ�е�c( ![]() )/c(
)/c( ![]() )=��
)=��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com