
【题目】下列实验操作.不正确的是
A. 给试管、烧杯、蒸发皿和烧瓶加热时都要垫上石棉网
B. 酒精灯内盛酒精不得超过容积的![]()
C. 往试管里装粉末状药品.可以用纸槽
D. 酒精灯不慎碰翻着火,应立即用湿布盖灭
科目:高中化学 来源: 题型:
【题目】两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的前10号元素中满足上述关系的元素共有
A. 1对 B. 2对 C. 3对 D. 4对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl和NaClO在酸性条件下可发生反应:ClO- + Cl- + 2H+ = Cl2↑+ H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况。
(1)此消毒液中NaClO可吸收空气中的CO2生成NaHCO3和HClO而变质。写出此化学反应方程式 。
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过以下装置检验气体的成分可以判断消毒液的变质情况。
限选试剂为:98%浓硫酸、1%品红溶液、1.0 mol·L-1 KI-淀粉溶液、1.0 mol·L-1NaOH、
澄清石灰水、饱和NaCl溶液
请完成下列探究实验方案。
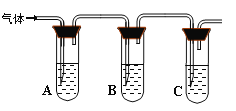
所加试剂 | 预期现象和结论 |
试管A中加足量① ; 试管B中加1%品红溶液; 试管C中加② 。 | 若A中溶液变蓝色,B中溶液不褪色,C中溶液变浑浊。则消毒液部分变质; ③ 则消毒液未变质; ④ 则消毒液完全变质。 |
(3)用滴定法测定消毒液中NaClO的浓度。实验步骤如下:
① 量取 25.00 mL消毒液放入锥形瓶中,加入过量的a mol·L-1 Na2SO3溶液b mL;
② 滴定分析。将c mol·L-1的酸性KMnO4溶液装入 (填酸式或碱式)滴定管中;KMnO4和剩余的Na2SO3发生反应。当溶液由无色变成浅红色,且保持半分钟内红色不褪时,停止滴定,记录数据。重复滴定实验2次,平均消耗酸性KMnO4溶液v mL;
滴定过程中涉及的反应有:NaClO+Na2SO3=NaCl+Na2SO4;
2KMnO4+5Na2SO3+3H2SO4=K2SO4+2MnSO4+5Na2SO4+3H2O
③ 计算消毒液中NaClO的浓度为 mol·L-1(用含a、b、c、v的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.氢气的燃烧热为△H=-285.5kJmol-1,则电解水的热化学方程式为2H2O (l)![]() 2H2(g)+O2(g) △H=+285.5kJmol-1
2H2(g)+O2(g) △H=+285.5kJmol-1
B.反应SO2(g)+2H2S(g)=3S(s)+2H2O(l)在常温下能自发进行,则该反应的△H<0
C.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=-38.6kJmol-1
2NH3(g)△H=-38.6kJmol-1
D.由C(石墨,s)=C(金刚石,s)△H=+1.90kJmol-1可知,金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关组成细胞的化学元素的叙述,错误的是( )
A. 在不同细胞内,组成它们的化学元素种类大体相同
B. 在所有细胞中,各种元素含量相同
C. 组成细胞的化学元素,在无机自然界都能找到
D. 组成细胞的最基本元素是碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是( )
A.Cu溶于稀HNO3:Cu+2 H++NO![]() ===Cu2++NO2↑+H2O
===Cu2++NO2↑+H2O
B.用石墨电极电解饱和食盐水:2 Cl-+2 H2O ![]() 2 OH-+H2↑+Cl2↑
2 OH-+H2↑+Cl2↑
C.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-===Fe(OH)2↓
D.向Fe(NO3)3溶液中加入过量的HI溶液:2 Fe3++2 I-===2 Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产,回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇,写出相应反应的化学方程式 。
(2)已知:
甲醇脱水反应 2CH3OH(g)═CH3OCH3(g) + H2O(g)△H1=﹣23.9kJmol﹣1
甲醇制烯烃反应 2CH3OH(g)═C2H4(g) + 2H2O(g)△H2=﹣29.1kJmol﹣1
乙醇异构化反应 C2H5OH(g)═CH3OCH3(g)△H3=" +" 50.7kJmol﹣1
则乙烯气相直接水合反应C2H4(g) + H2O(g)═C2H5OH(g)的△H= kJmol﹣1,与间接水合法相比,气相直接水合法的优点是 ;
(3)气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中![]() :
:![]() =1:1)
=1:1)
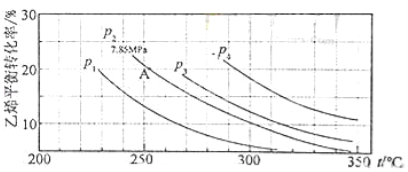
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数Kp= 。
(A点总压为7.85MPa,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数);
②图中压强(P1,P2,P3,P4)大小顺序为 ,理由是 ;
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290℃,压强6.9MPa,![]() :
:![]() =0.6:1,乙烯的转化率为5%,若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有 、 。
=0.6:1,乙烯的转化率为5%,若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
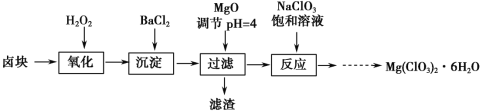
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
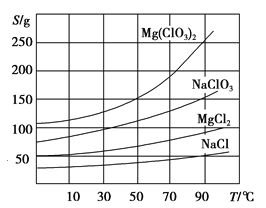
(1)过滤所需要的主要玻璃仪器有__ __ _。
(2)加MgO后过滤所得滤渣的主要成分为 。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为_________________________。
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20.00 mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1 K2Cr2O7溶液滴定剩余的Fe2+至终点,此过程中反应的离子方程式为:Cr2O![]() +6Fe2++14H+=2Cr3++6Fe3++7H2O。
+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00 mL。
①写出步骤2中发生反应的离子方程式:____________________________;
②产品中Mg(ClO3)2·6H2O的质量分数为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com