
| 元素 | 相关信息 |
| X | 元索周期表中核电荷数最小的元素 |
| Y | Y的一种核素常用于考古,其一种同素异形体为自然界最硬的物质 |
| Z | Z是大气中含量最多的元素,其某些氧化物为大气中常见的污染物 |
| W | W是地壳中含量最高的金属元素 |
| M | 常见金属,单质呈紫红色 |
分析 X、Y、Z、W、M是元素周期表中原子序数依次增大的五种元素,X是元素周期表中核电荷数最小的元素,故X为H元素;Y的一种核素常用于考古,其一种同素异形体为自然界最硬的物质,则Y为C元素;Z是大气中含量多的元素,其某些氧化物为大气中常见的污染物,则Z为N元素;W是地壳中含量最高的金属元素,则W为Al;M是常见金属,单质呈紫红色,故M为Cu,据此解答.
解答 解:X、Y、Z、W、M是元素周期表中原子序数依次增大的五种元素,X是元素周期表中核电荷数最小的元素,故X为H元素;Y的一种核素常用于考古,其一种同素异形体为自然界最硬的物质,则Y为C元素;Z是大气中含量多的元素,其某些氧化物为大气中常见的污染物,则Z为N元素;W是地壳中含量最高的金属元素,则W为Al;M是常见金属,单质呈紫红色,故M为Cu.
(1)W是Al元素,位于元素周期表第三周期第ⅢA族;Al3+、N3-离子电子层结构相同,核电荷数越大离子半径越小,故离子半径:Al3+<N3-,
故答案为:三;ⅢA;小;
(2)N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能大于氧原子;M为Cu元素,原子核外有29个电子,处于的第四周期IB族,基态原子价电子排布式是3d104s1,
故答案为:大;3d104s1;
(3)H与C可形成多种化合物,其中常用来切割或焊接金属的气体为C2H2,结构式为H-C≡C-H,分子中σ键和π键之比是3:2,空间构型是:直线形,
故答案为:3:2;直线形;
(4)H与N形成的最简单化合物为NH3,用途非常广泛,可以制硝酸、作制冷剂、制化肥、制纯碱等,该化合物具有较强的还原性,加热时能将CuO还原,反应生成Cu、氮气与水,该反应的化学方程式为:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O,
故答案为:制硝酸;作制冷剂;3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O;
(5)已知:①CH4 (g)+4NO2 (g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4 (g)+4NO(g)=2N2 (g)+CO2 (g)+2H2O(g)△H=-1160kJ•mol-1
根据盖斯定律①+②得:2CH4 (g)+4NO2 (g)=2CO2(g)+2N2 (g)+4H2O(g)△H=-1734kJ•mol-1,即热化学方程式为CH4 (g)+2NO2 (g)=CO2(g)+N2 (g)+2H2O(g)△H=-867kJ•mol-1,
故答案为:CH4 (g)+2NO2 (g)=CO2(g)+N2 (g)+2H2O(g)△H=-867kJ•mol-1.
点评 本题是对物质结构的考查,涉及结构性质位置关系、电离能、核外电子排布、化学键、热化学方程式书写等,难度不大,注意对理解掌握同周期第一电离能异常原因.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 | 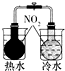 | 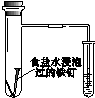 | 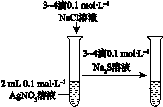 |
| 验证化学能 转化为电能 | 证明温度 对平衡移动的影响 | 验证铁发生析氢腐蚀 | 验证AgCl 溶解度大于Ag2S |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
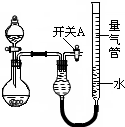 某同学设计如图所示装置分别进行探究实验(夹持装置已略去)
某同学设计如图所示装置分别进行探究实验(夹持装置已略去)| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| ① | Cu、稀HNO3 | H2O | |
| ② | NaOH固体、浓氨水 | NH3 | |
| ③ | Na2CO3固体、稀H2SO4 | CO2 | |
| ④ | 镁铝合金、NaOH溶液(足量) | H2 | H2O |
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| 1 | 1.0g | 10.0mL | 347.5mL |
| 2 | 1.0g | 10.0mL | 335.0mL |
| 3 | 1.0g | 10.0mL | 344.5mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
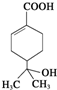
| A. | 分子中含有两种官能团 | |
| B. | 可使溴水和酸性高锰酸钾溶液褪色,且原理相同 | |
| C. | 能发生加成、取代、氧化、消去等反应 | |
| D. | 与钠和氢氧化钠溶液都能发生反应,且得到的产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该  有机物的系统命名为:3-乙基-5-甲基庚烷 有机物的系统命名为:3-乙基-5-甲基庚烷 | |
| B. | 等质量的某烷烃a和某烯烃b,两者完全烧烧后产生的CO2的量有可能a>b | |
| C. |  该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 | |
| D. | 1mol该有机物 在一定条件下与足量NaOH溶液完全反应,最多可消耗NaOH 12mol 在一定条件下与足量NaOH溶液完全反应,最多可消耗NaOH 12mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| A | 原子半径是周期表所有元素中最小的 |
| B | 单质常温下为双原子分子,其氢化物水溶液使酚酞变红 |
| C | 基态原子核外S能级上有电子,且p能级上只有一个轨道排满 |
| D | 同周期中电负性最小 |
| E | E的族序数与周期数之差为4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com