
【题目】A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D,E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是
A. BADCE B. ECDBA C. ABCDE D. CDABE
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】工业上制备高纯硅有多种方法,其中的一种工艺流程如下:
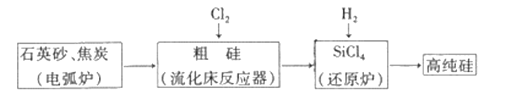
已知:流化床反应的产物中,除SiCl4外,还有SiHCl3、SiH2Cl2、SiH3Cl、FeCl3等。下列说法正确的是
A. 电弧炉中发生的反应为C+SiO2![]() CO2↑+Si
CO2↑+Si
B. SiCl4进入还原炉之前需要经过蒸馏提纯
C. 每生产l mol高纯硅,需要44. 8L Cl2(标准状况)
D. 该工艺Si的产率高,符合绿色化学要求
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.向Na2CO3溶液中逐滴加入HCl,直到不再生成CO2气体为止,在此过程中.溶液中的HCO3-浓度变化是先变大后变小(溶液体积变化均忽略不计)
B.向NaHCO3溶液中加入Ba(OH)2固体,CO32-的浓度变化是先变大后变小(溶液体积变化均忽略不计)
C.有含0.2molNa2CO3和含0.3molHCl的两种溶液:①将Na2CO3溶液逐滴滴入HCl溶液中;②将HCl溶液逐滴滴入Na2CO3溶液中,①②两种操作生成的CO2体积之比为3:2
D.将等质量的Na2O和Na2O2样品分别放入等量的水中,所得溶液的质量分数分别为a%和b%,则a、b的关系是a=b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究金属单质M与盐溶液的反应,某同学进行了下列实验,实验过程及现象如图所示,结合实验现象判断该同学得出的下列结论中正确的是

A. 向滤液中滴加盐酸的实验现象是产生白色沉淀
B. 滤渣可能是两种单质的混合物
C. 滤渣在足量的稀硝酸中能完全溶解
D. 加入的金属M可能是镁或钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒、杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得:(已知H2C2O4中的碳为+3价)2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O。试回答下列问题。
(1)该反应中氧化产物的化学式是___________;被还原的元素是___________。
(2)用双线桥标出上述反应的电子转移情况______。
2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O
(3)若反应共产生了4.48L气体(标准状况),则反应转移电子的物质的量为_________mol,消耗还原剂的物质的量为___________mol。
(4)标准状况下44.8mL的ClO2气体恰好能与50mL 0.1mol·L-1的Na2SO3溶液液完全反应,生成Na2SO4,氯元素在产物中的化合价为___________;此过程说明ClO2具有____(填“氧化”或“还原”)性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向下列各溶液中通入足量CO2气体,最终有浑浊现象产生的是
①饱和Na2CO3溶液 ②澄清石灰水 ③NaAlO2溶液
④CaCl2溶液 ⑤Na2SiO3溶液
A. 全部 B. 除①④⑤外
C. 除①②④外 D. 除②④外
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某燃煤发电厂处理废气的装置示意图.下列说法正确的是( )

A. 此过程中没有分解反应
B. 整个过程的反应可表示为: 2SO2+2CaCO3+O2═2CaSO4+2CO2
C. 使用此废气处理装置可减少CO2的排放
D. 此过程中S元素的化合价未发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用方铅矿精矿(主要为PbS)和软锰矿(主要为MnO2,还有少量Fe2O3,Al2O3等杂质)制备PbSO4和Mn3O4的工艺流程如下:

已知:①PbS+MnO2+4H+=Mn2++Pb2++S+2H2O
②25℃时,Ksp(PbCl2)=1.6×10-5,Ksp(PbSO4)=1.8×10-8
③PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq)△H>0
PbCl42-(aq)△H>0
(1)80℃用盐酸处理两种矿石,为加快酸浸速率,还可采用的方法是_______________(任写一种)。
(2)向酸浸液中加入饱和食盐水的目的是_________________;加入物质X可用于调节酸浸液的pH值,物质X可以是___________(填字母)。
A.MnCO3 B.NaOH C.ZnO D.PbO
(3)滤渣中含有两种金属杂质形成的化合物,其成分为_____________(写化学式);
请设计分离两种金属化合物的路线图(用化学式表示物质,用箭头表示转化关系,箭头上注明试剂和分离方法)。______________________________________
(4)向滤液2中通入NH3和O2发生反应,写出总反应的离子方程式。___________________________________
(5)用Mn3O4为原料可以获得金属锰,选择合适的冶炼方法为___________(填字母)。
A.热还原法 B.电解法 C.热分解法
(6)求25℃氯化铅沉淀转化为硫酸铅沉淀反应的平衡常数K=___________(保留到整数位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com