
【题目】用方铅矿精矿(主要为PbS)和软锰矿(主要为MnO2,还有少量Fe2O3,Al2O3等杂质)制备PbSO4和Mn3O4的工艺流程如下:

已知:①PbS+MnO2+4H+=Mn2++Pb2++S+2H2O
②25℃时,Ksp(PbCl2)=1.6×10-5,Ksp(PbSO4)=1.8×10-8
③PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq)△H>0
PbCl42-(aq)△H>0
(1)80℃用盐酸处理两种矿石,为加快酸浸速率,还可采用的方法是_______________(任写一种)。
(2)向酸浸液中加入饱和食盐水的目的是_________________;加入物质X可用于调节酸浸液的pH值,物质X可以是___________(填字母)。
A.MnCO3 B.NaOH C.ZnO D.PbO
(3)滤渣中含有两种金属杂质形成的化合物,其成分为_____________(写化学式);
请设计分离两种金属化合物的路线图(用化学式表示物质,用箭头表示转化关系,箭头上注明试剂和分离方法)。______________________________________
(4)向滤液2中通入NH3和O2发生反应,写出总反应的离子方程式。___________________________________
(5)用Mn3O4为原料可以获得金属锰,选择合适的冶炼方法为___________(填字母)。
A.热还原法 B.电解法 C.热分解法
(6)求25℃氯化铅沉淀转化为硫酸铅沉淀反应的平衡常数K=___________(保留到整数位)。
【答案】 粉碎矿石或搅拌或适当增加盐酸浓度 增大PbCl2的溶解度 AD Al(OH)3、Fe(OH)3 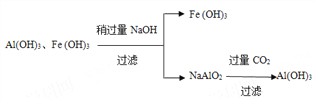 6Mn2++12NH3+6H2O+O2=2Mn3O4+12NH4+ A 889
6Mn2++12NH3+6H2O+O2=2Mn3O4+12NH4+ A 889
【解析】(1)80℃用盐酸处理两种矿石,为加快酸浸速率,还可采用的方法是粉碎矿石或搅拌或适当增加盐酸浓度;(2)由于PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq),向酸浸液中加入饱和食盐水,溶液中氯离子浓度较大,可使平衡正向移动,增大PbCl2的溶解度;加入物质X可用于调节酸浸液的pH值,选项中各物质均能消耗氢离子起调节pH,但选用氢氧化钠溶液会溶解氢氧化铝,产生干扰离子偏铝酸根离子,选用氧化锌会引入新杂质,故物质X可以是AD;(3)根据软锰矿中还有少量Fe2O3,Al2O3等杂质,制备过程中必须除杂,故滤渣中含有两种金属杂质形成的化合物的成分为Al(OH)3、Fe(OH)3;分离两种金属化合物可利用氢氧化铝为两性氢氧化物利用强碱溶解后过滤,再利用二氧化碳将偏铝酸盐处理得到氢氧化铝,流程如下:
PbCl42-(aq),向酸浸液中加入饱和食盐水,溶液中氯离子浓度较大,可使平衡正向移动,增大PbCl2的溶解度;加入物质X可用于调节酸浸液的pH值,选项中各物质均能消耗氢离子起调节pH,但选用氢氧化钠溶液会溶解氢氧化铝,产生干扰离子偏铝酸根离子,选用氧化锌会引入新杂质,故物质X可以是AD;(3)根据软锰矿中还有少量Fe2O3,Al2O3等杂质,制备过程中必须除杂,故滤渣中含有两种金属杂质形成的化合物的成分为Al(OH)3、Fe(OH)3;分离两种金属化合物可利用氢氧化铝为两性氢氧化物利用强碱溶解后过滤,再利用二氧化碳将偏铝酸盐处理得到氢氧化铝,流程如下: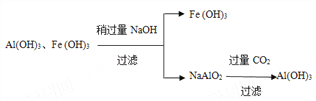 ;(4)向滤液2中通入NH3和O2发生反应生成Mn3O4,总反应的离子方程式为6Mn2++12NH3+6H2O+O2=2Mn3O4+12NH4+;(5)根据金属活动顺序,用Mn3O4为原料可以获得金属锰,选择合适的冶炼方法为热还原法,答案选A;(6)求25℃氯化铅沉淀转化为硫酸铅沉淀反应PbCl2(s)+SO42-(aq)
;(4)向滤液2中通入NH3和O2发生反应生成Mn3O4,总反应的离子方程式为6Mn2++12NH3+6H2O+O2=2Mn3O4+12NH4+;(5)根据金属活动顺序,用Mn3O4为原料可以获得金属锰,选择合适的冶炼方法为热还原法,答案选A;(6)求25℃氯化铅沉淀转化为硫酸铅沉淀反应PbCl2(s)+SO42-(aq)![]() 2Cl-(aq)+PbSO4(s)的平衡常数K=
2Cl-(aq)+PbSO4(s)的平衡常数K=![]() =
=![]() 。
。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D,E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是
A. BADCE B. ECDBA C. ABCDE D. CDABE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,其元素特征信息如下表。回答下列问题:

(1)写出下列元素的符号:A:________,E:________;
(2)写出C与B 形成的两种离子化合物的化学式_______;______。
(3)指出 E 在周期表中的位置 _____________。
(4)B、C、D三种元素的离子半径由大到小的顺序是_________(写具体的元素符号)。
(5)E单质和C的最高价氧化物对应水化物水溶液反应的离子方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列常见物质的俗名与化学式相对应的是:
A. 熟石灰--CaO B. 铝热剂--Fe、Al2O3
C. 石膏--CaSO4·2H2O D. 绿矾--CuSO4·5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色气体A在一种黄绿色气体B中可以安静的燃烧,发出苍白色火焰,反应生成气体C.B与金属D反应可生成白色固体E,D在空气中燃烧生成浅黄色固体F,D与水反应又可生成A.试回答下列问题:

(1)写出下列物质的化学式:B________、C_________、E___________。
(2)写出B与水反应的离子方程式:_________________________________
(3)为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,实验方案设计错误的是____(填字母)
A.④和⑤ B.只有③ C.③和④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去),下列推断不正确的是( )
![]()
A. 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
B. 若D是一种强碱,则A、B、C均可与X反应生成D
C. 若D为NaCl,且A可与C生成B,则E可能是CO2
D. 若D是一种强酸,则A既可以是单质,也可以是化合物,且D可能与铜反应生成B或C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为周期表前20号元素中某些元素的有关数据:
元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
原子半径(10-10m) | 1.86 | 1.52 | 0.66 | 0.53 | 0.77 | 1.10 | 0.99 | 2.31 | 0.70 | 0.64 |
最高价态 | +1 | +1 | —— | +1 | +4 | +5 | +7 | +1 | +5 | —— |
最低价态 | —— | —— | -2 | -1 | -4 | -3 | -1 | —— | -3 | -1 |
试回答下列问题:(用对应的元素符号或物质的化学式表示)
(1)写出⑧的原子结构示意图:________;
(2)上述⑤、⑥、⑦号元素中某2种元素形成的化合物中,每一个原子都满足最外层为8电子稳定结构的物质可能是______、____;
(3)某元素R的原子半径为1.04×10-10m,该元素在周期表中的位置是___________。
(4)以上10种元素的原子中,还原性最强的是__________(元素符号)。
(5)③、⑦、①、⑩四种元素形成的离子,其半径由小到大的顺序为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com