
【题目】下表为周期表前20号元素中某些元素的有关数据:
元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
原子半径(10-10m) | 1.86 | 1.52 | 0.66 | 0.53 | 0.77 | 1.10 | 0.99 | 2.31 | 0.70 | 0.64 |
最高价态 | +1 | +1 | —— | +1 | +4 | +5 | +7 | +1 | +5 | —— |
最低价态 | —— | —— | -2 | -1 | -4 | -3 | -1 | —— | -3 | -1 |
试回答下列问题:(用对应的元素符号或物质的化学式表示)
(1)写出⑧的原子结构示意图:________;
(2)上述⑤、⑥、⑦号元素中某2种元素形成的化合物中,每一个原子都满足最外层为8电子稳定结构的物质可能是______、____;
(3)某元素R的原子半径为1.04×10-10m,该元素在周期表中的位置是___________。
(4)以上10种元素的原子中,还原性最强的是__________(元素符号)。
(5)③、⑦、①、⑩四种元素形成的离子,其半径由小到大的顺序为___________。
【答案】 CCl4 PCl3 第三周期第VIA族 K r(Na+)<r(F-)<r(O2-)<r(Cl-)
CCl4 PCl3 第三周期第VIA族 K r(Na+)<r(F-)<r(O2-)<r(Cl-)
【解析】
主族元素的最高正价=最外层电子数=族序数(O、F无正价),主族元素的最低负价的绝对值=8-最外层电子数;同主族元素原子,从上到下原子半径逐渐增大,①Na、②Li、④H、 ⑧ K;⑦Cl、⑩F;⑥P、⑨N;同周期元素的原子,从左到右原子半径逐渐减小,③O、⑤C;
结论:①Na ②Li ③O ④H ⑤C ⑥P ⑦Cl ⑧K ⑨N ⑩F。
(1)⑧为K,原子结构示意图: ;
;
答案:
(2)上述⑤C 、⑥P、 ⑦Cl元素中某2种元素形成的化合物中,要想满足最外层为8电子稳定结构,只要符合:化合价的绝对值+最外层电子数=8即可,因此物质可能是CCl4、PCl3;
答案:CCl4 PCl3
(3)1.04×10-10m介于1.10×10-10m和0.99×10-10m之间,即半径大小介于P和Cl之间,故为S,位于第三周期,第ⅥA族;
答案:第三周期,第ⅥA族
(4)金属性越强,失电子能力越强,同一主族从上到下金属性增强,锂、钠、钾的最外层只有一个电子,失一个电子的能力较强,其中K失电子能力最强,还原性最强的的是K;
答案:K
(5)电子层越多半径越大,r(Cl-)半径最大;当核外电子排布相同时,核电荷数越大,半径越小,因此r(Na+)<r(F-)<r(O2-)<r(Cl-)。
答案: r(Na+)<r(F-)<r(O2-)<r(Cl-)


科目:高中化学 来源: 题型:
【题目】用方铅矿精矿(主要为PbS)和软锰矿(主要为MnO2,还有少量Fe2O3,Al2O3等杂质)制备PbSO4和Mn3O4的工艺流程如下:

已知:①PbS+MnO2+4H+=Mn2++Pb2++S+2H2O
②25℃时,Ksp(PbCl2)=1.6×10-5,Ksp(PbSO4)=1.8×10-8
③PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq)△H>0
PbCl42-(aq)△H>0
(1)80℃用盐酸处理两种矿石,为加快酸浸速率,还可采用的方法是_______________(任写一种)。
(2)向酸浸液中加入饱和食盐水的目的是_________________;加入物质X可用于调节酸浸液的pH值,物质X可以是___________(填字母)。
A.MnCO3 B.NaOH C.ZnO D.PbO
(3)滤渣中含有两种金属杂质形成的化合物,其成分为_____________(写化学式);
请设计分离两种金属化合物的路线图(用化学式表示物质,用箭头表示转化关系,箭头上注明试剂和分离方法)。______________________________________
(4)向滤液2中通入NH3和O2发生反应,写出总反应的离子方程式。___________________________________
(5)用Mn3O4为原料可以获得金属锰,选择合适的冶炼方法为___________(填字母)。
A.热还原法 B.电解法 C.热分解法
(6)求25℃氯化铅沉淀转化为硫酸铅沉淀反应的平衡常数K=___________(保留到整数位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属的叙述中正确的是( )
A. 金属在自然界中只能以化合态的形式存在
B. 地壳中含量最多的金属元素是铁
C. 铝是当今世界上年产量最高的金属
D. 铜可用来制作导线、电缆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国《Science》上发表论文,宣布发现了一种 Al 的超原子结构,这种超原子(Al13)是以 1 个 Al 原子 在中心,12 个 Al 原子在表面形成的三角二十面体结构。这种超原子具有 40 个价电 子(价电 子即主族元 素的最外层电子数)时最稳定。请预测稳定的 Al13 所带的电荷为
A. -1 B. +2 C. +3 D. 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】著名化学家徐光宪,因为在稀土萃取领域取得的卓越成就被誉为“稀土界的袁隆平”;2009 年,胡锦涛 主席为其颁发了“国家最高科学技术奖”。稀土元素是指镧系的 15 种元素,加上钪和钇共 17 种元素。下列 说法正确的是
A. 稀土元素全部是金属元素 B. 要萃取出碘酒中的碘可用 KOH 溶液做萃取剂
C. 镧系元素属于主族元素 D. 某些稀土元素在地壳中的含量高于铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如下图所示(部分产物及反应条件已略去)。已知A、B为气态单质,F是地壳中含量最多的金属元素的单质;E、H、I为氧化物,E为黑色固体,I为红棕色气体;M为红褐色沉淀。请回答下列问题:
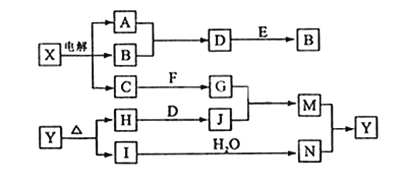
(1)B中所含元素位于周期表中第____周期____族。
(2)A在B中燃烧的现象是_______________。
(3)D+E→B的反应中,被氧化与被还原的物质的物质的量比是________。
(4)G+J→M的离子方程式是 _________________。
(5)Y受热分解的化学方程式是 ___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
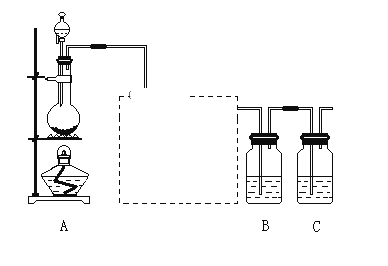
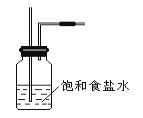
(1)装置A的分液漏斗中盛装的试剂是_______,烧瓶中加入的试剂是_____。
(2)饱和食盐水的作用________________ 。
(3)装置B中盛放的试剂是_____(选填下列所给试剂的代码),实验现象为_______,化学反应方程式是_________,该反应属于四种基本反应类型中的___反应。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)从原子结构的角度简要分析氯元素的非金属性比硫元素的非金属性强的原因_________
(5)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例)。________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠离子电池正成为化学电源的新宠。
(1)有一种新型的高能电池—钠硫电池(熔融的钠、硫为两极,以Na+导电的βAl2O3陶瓷作固体电解质),反应式为2Na+xS ![]() Na2Sx。
Na2Sx。
①充电时,钠极与外电源________(填“正”或“负”)极相连。其阳极反应式:_____________。
②用该电池作电源电解(如图)NaCl溶液(足量),写出电解NaCl溶液的离子方程式:________________________________。

③若用该钠硫电池作电源在一铁片上镀铜,此铁片与__________(填“钠”或“硫”)极相连。
(2)“Na-CO2”电池可将CO2变废为宝。我国科研人员研制出的可充电“ Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 ![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:

①放电时,正极的电极反应式为_____________________________。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e-时,两极的质量差为________ g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com