
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
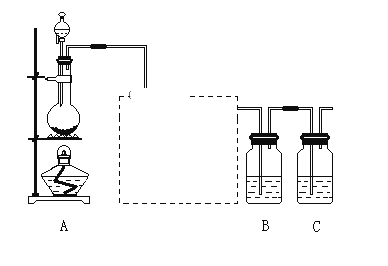
(1)装置A的分液漏斗中盛装的试剂是_______,烧瓶中加入的试剂是_____。
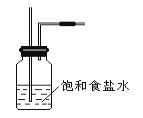
(2)饱和食盐水的作用________________ 。
(3)装置B中盛放的试剂是_____(选填下列所给试剂的代码),实验现象为_______,化学反应方程式是_________,该反应属于四种基本反应类型中的___反应。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)从原子结构的角度简要分析氯元素的非金属性比硫元素的非金属性强的原因_________
(5)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例)。________
【答案】浓盐酸 MnO2 除去Cl2中的HCl气体 A 有淡黄色沉淀生成 Na2S+Cl2=2NaCl+S↓ 置换 Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl<S,因此,在反应中Cl原子比S原子更容易获得电子达稳定结构,故氯元素的非金属性比硫元素的非金属性强 HCl的稳定性比H2S的稳定性强或者HClO4的酸性比H2SO4的酸性强。(其他合理答案均可)
【解析】
(1)从实验室制取氯气的原理分析;
(2)从除杂质的角度思考;
(3)从置换反应判断元素非金属性强弱分析;
(4)从原子结构的特点思考;
(5)从判断元素非金属性强弱的方法去思考。
(1)为验证氯元素的非金属性比硫元素的非金属性强,需要用氯气置换出硫,则必须用装置A制备氯气,实验室通常用浓盐酸与二氧化锰反应制取氯气,则A装置中A的分液漏斗中盛装的试剂是浓盐酸,烧瓶中加入的试剂是MnO2.故答案为:浓盐酸;MnO2。
(2)由于用浓盐酸制取氯气,且需要加热,即实验过程中要挥发出HCl气体,可以使用洗气瓶,瓶内盛装饱和食盐水,既除去HCl,又降低氯气在水中的溶解度,故答案为:除去Cl2中的HCl气体。
(3)要在B中发生氯气置换出硫的反应,在给定试剂中只能选取Na2S溶液,发生的是置换反应,化学方程式为:Na2S+Cl2=2NaCl+S↓,
故答案为:A;有淡黄色沉淀生成;Na2S+Cl2=2NaCl+S↓;置换。
(4)从氯原子和硫原子的核外电子排布可知:Cl与S分别为第三周期元素的VIIA和VIA,原子半径:S>Cl,因为Cl的核电荷数大于S,Cl的原子核对最外层电子的吸引能力比S强,即Cl的电子能力比S强,非金属性Cl比S强.答案为:Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl<S,因此,在反应中Cl原子比S原子更容易获得电子达稳定结构,故氯元素的非金属性比硫元素的非金属性强,
故答案为:Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl<S,因此,在反应中Cl原子比S原子更容易获得电子达稳定结构,故氯元素的非金属性比硫元素的非金属性强。
(5)我们可从最高价氧化物对应水化物的酸性强弱、与氢气反应的难以程度、气态氢化物的稳定性等来判断元素非金属性的强弱,对Cl和S来说,可具体为:HCl的稳定性比H2S的稳定性强或者HClO4的酸性比H2SO4的酸性强,
故答案为:HCl的稳定性比H2S的稳定性强或者HClO4的酸性比H2SO4的酸性强.(其他合理答案均可)。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去),下列推断不正确的是( )
![]()
A. 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
B. 若D是一种强碱,则A、B、C均可与X反应生成D
C. 若D为NaCl,且A可与C生成B,则E可能是CO2
D. 若D是一种强酸,则A既可以是单质,也可以是化合物,且D可能与铜反应生成B或C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为周期表前20号元素中某些元素的有关数据:
元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
原子半径(10-10m) | 1.86 | 1.52 | 0.66 | 0.53 | 0.77 | 1.10 | 0.99 | 2.31 | 0.70 | 0.64 |
最高价态 | +1 | +1 | —— | +1 | +4 | +5 | +7 | +1 | +5 | —— |
最低价态 | —— | —— | -2 | -1 | -4 | -3 | -1 | —— | -3 | -1 |
试回答下列问题:(用对应的元素符号或物质的化学式表示)
(1)写出⑧的原子结构示意图:________;
(2)上述⑤、⑥、⑦号元素中某2种元素形成的化合物中,每一个原子都满足最外层为8电子稳定结构的物质可能是______、____;
(3)某元素R的原子半径为1.04×10-10m,该元素在周期表中的位置是___________。
(4)以上10种元素的原子中,还原性最强的是__________(元素符号)。
(5)③、⑦、①、⑩四种元素形成的离子,其半径由小到大的顺序为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃A在一定条件下可以按下图进行反应
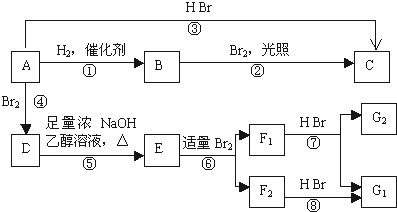
已知D为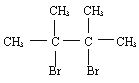 ,F1和F2互为同分异构体,G1和G2互为同分异构体。请填空:
,F1和F2互为同分异构体,G1和G2互为同分异构体。请填空:
(1)A的结构简式是___________________。
(2)框图中属于取代反应的是(填数字代号)_______,框图中属于加成反应的是 _______________
(3)写出D→E的方程式__________________________________.
(4)G1的结构简式是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g)![]() 4NO2(g)+O2(g) △H>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
4NO2(g)+O2(g) △H>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/(mol·L—1) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是
A. 500s内O2的平均生成速率为7.4×l0—4mol·L—1·s—1
B. T1温度下该反应达到平衡时,平衡混合物中NO2的体积分数为50%
C. 达到平衡后,其他条件不变,将容器体积压缩到原来的1/2,则c(N2O5)>5.00mol·L—1
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若K1<K2,则T1>T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O反应,下列说法正确的是( )
MnCl2+Cl2↑+2H2O反应,下列说法正确的是( )
A. 每消耗1molMnO2生成Cl2的体积为22.4L
B. 氧化剂与还原剂的物质的量之比为1:4
C. 氧化性:MnO2>Cl2
D. 反应中每生成1molCl2时,转移电子的物质的量为4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关物质的量浓度关系正确的是
A. Na2S 溶液中 c(OH﹣)=c(H+)+c(HS﹣)+2c(H2S)
B. Na2CO3溶液中:c(Na+)=2c(CO32﹣)+2c(HCO3﹣)
C. 室温下,pH=1的CH3COOH溶液和pH=13的NaOH溶液等体积混合,溶液中离子浓度的大小顺序:c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+)
D. pH=4的0.1molL﹣1NaHC2O4溶液中c(H C2O4﹣)>c(H+)>c(H2C2O4)>c(C2O42﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
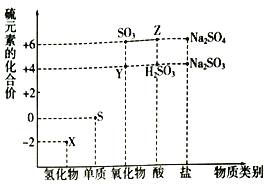
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有______________(填化学式)((填一种就可以)。
(2)将X与Y混合,可生成淡黄色固体。该反应中氧化剂与还原剂的物质的量之比为_______________。
(3) Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为____________。
(4)Na2S2O3是重要的化工原料.从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是_____________(填字母)。
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24 mL 0.05 mol/L的Na2SO3溶液与 20 mL 0.02 mol/L的溶液恰好反应时,Cr元素在还原产物中的化合价为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com