
ЎҫМвДҝЎҝДЖАлЧУөзіШХэіЙОӘ»ҜС§өзФҙөДРВіиЎЈ
(1)УРТ»ЦЦРВРНөДёЯДЬөзіШЎӘДЖБтөзіШ(ИЫИЪөДДЖЎўБтОӘБҪј«Ј¬ТФNaЈ«өјөзөДҰВAl2O3МХҙЙЧч№ММеөзҪвЦК)Ј¬·ҙУҰКҪОӘ2NaЈ«xS ![]() Na2SxЎЈ
Na2SxЎЈ
ўЩідөзКұЈ¬ДЖј«УлНвөзФҙ________(МоЎ°ХэЎұ»тЎ°ёәЎұ)ј«ПаБ¬ЎЈЖдСфј«·ҙУҰКҪЈә_____________ЎЈ
ўЪУГёГөзіШЧчөзФҙөзҪв(ИзНј)NaClИЬТә(ЧгБҝ)Ј¬РҙіцөзҪвNaClИЬТәөДАлЧУ·ҪіМКҪЈә________________________________ЎЈ

ўЫИфУГёГДЖБтөзіШЧчөзФҙФЪТ»МъЖ¬ЙП¶ЖНӯЈ¬ҙЛМъЖ¬Ул__________(МоЎ°ДЖЎұ»тЎ°БтЎұ)ј«ПаБ¬ЎЈ
ЈЁ2Ј©Ў°NaЈӯCO2ЎұөзіШҝЙҪ«CO2ұд·ПОӘұҰЎЈОТ№ъҝЖСРИЛФұСРЦЖіцөДҝЙідөзЎ° NaЈӯCO2ЎұөзіШЈ¬ТФДЖІӯәН¶аұЪМјДЙГЧ№Ь(MWCNT)ОӘөзј«ІДБПЈ¬ЧЬ·ҙУҰОӘ4NaЈ«3CO2 ![]() 2Na2CO3Ј«CЎЈ·ЕөзКұёГөзіШЎ°ОьИлЎұCO2Ј¬Жд№ӨЧчФӯАнИзНјЛщКҫЈә
2Na2CO3Ј«CЎЈ·ЕөзКұёГөзіШЎ°ОьИлЎұCO2Ј¬Жд№ӨЧчФӯАнИзНјЛщКҫЈә

ўЩ·ЕөзКұЈ¬Хэј«өДөзј«·ҙУҰКҪОӘ_____________________________ЎЈ
ўЪИфЙъіЙөДNa2CO3әНCИ«ІҝіБ»эФЪөзј«ұнГжЈ¬өұЧӘТЖ0.2 mol eЈӯКұЈ¬БҪј«өДЦКБҝІоОӘ________ gЎЈ
Ўҫҙр°ёЎҝ ёә Na2SxЈӯ2eЈӯ===xSЈ«2NaЈ«(»тS![]() Јӯ2eЈӯ===xS) 2ClЈӯЈ«2H2O
Јӯ2eЈӯ===xS) 2ClЈӯЈ«2H2O![]() 2OHЈӯЈ«H2ЎьЈ«Cl2Ўь ДЖ 3CO2Ј«4NaЈ«Ј«4eЈӯ===2Na2CO3Ј«C 15.8
2OHЈӯЈ«H2ЎьЈ«Cl2Ўь ДЖ 3CO2Ј«4NaЈ«Ј«4eЈӯ===2Na2CO3Ј«C 15.8
ЎҫҪвОцЎҝ(1)ўЩ·ЕөзКұЈ¬ДЖОӘФӯөзіШёәј«Ј»ідөзКұЈ¬ДЖОӘөзҪвіШөДТхј«Ј¬УлөзФҙөДёәј«ПаБ¬Ј»ёщҫЭ·ҙУҰ№жВЙРҙСфј«·ҙУҰКҪЎЈ
ўЪөзҪвұҘәНКіСОЛ®ЙъіЙЗвСх»ҜДЖЎўЗвЖшәНВИЖшЎЈ
ўЫФЪТ»МъЖ¬ЙП¶ЖНӯ,НӯЧчСфј«,МъЧчТхј«УҰУлёәј«ПаБ¬,ЛщТФИфУГёГДЖБтөзіШЧчөзФҙФЪТ»МъЖ¬ЙП¶ЖНӯ,ҙЛМъЖ¬Улёәј«ДЖПаБ¬ЎЈ
ЈЁ2Ј©ўЩ·ЕөзКұЈ¬Хэј«·ўЙъ»№Фӯ·ҙУҰЈ¬ҪбәПЧЬ·ҙУҰҪшРРКйРҙёГөзј«·ҙУҰКҪЎЈ
ўЪТАҫЭөзЧУЧӘТЖКШәг№жВЙЈәёщҫЭХэј«ј«·ҙУҰЈ¬ҪбәПөзЧУЧӘТЖЗйҝцЈ¬јЖЛгіцХэј«ЦКБҝөДФцјУБҝЈ»ёщҫЭёәј«ј«·ҙУҰЈ¬ҪбәПөзЧУЧӘТЖЗйҝцЈ¬јЖЛгіцёәј«ЦКБҝөДФцјУБҝЈ»ЧоәујЖЛгБҪј«өДЦКБҝІоЎЈ
(1)ўЩёщҫЭөзіШ·ҙУҰКҪЦӘ,ідөзКұ,ДЖАлЧУөГөзЧУ·ўЙъ»№Фӯ·ҙУҰ,ЛщТФДЖЧчТхј«,УҰёГБ¬ҪУөзФҙёәј«Ј»Сфј«ЙПК§өзЧУ·ўЙъСх»Ҝ·ҙУҰ,өзј«·ҙУҰКҪОӘNa2SxЈӯ2eЈӯ===xSЈ«2NaЈ«(»тS![]() Јӯ2eЈӯ===xS)Ј»ХэИ·ҙр°ё:ёәЈ»Na2SxЈӯ2eЈӯ===xSЈ«2NaЈ«(»тS
Јӯ2eЈӯ===xS)Ј»ХэИ·ҙр°ё:ёәЈ»Na2SxЈӯ2eЈӯ===xSЈ«2NaЈ«(»тS![]() Јӯ2eЈӯ===xS)ЎЈ
Јӯ2eЈӯ===xS)ЎЈ
ўЪөзҪвNaClИЬТәЈ¬ЙъіЙЗвСх»ҜДЖЎўЗвЖшәНВИЖшЈ¬АлЧУ·ҪіМКҪЈә2ClЈӯЈ«2H2O![]() 2OHЈӯЈ«H2ЎьЈ«Cl2ЎьЈ»ХэИ·ҙр°ёЈә2ClЈӯЈ«2H2O
2OHЈӯЈ«H2ЎьЈ«Cl2ЎьЈ»ХэИ·ҙр°ёЈә2ClЈӯЈ«2H2O![]() 2OHЈӯЈ«H2ЎьЈ«Cl2ЎьЎЈ
2OHЈӯЈ«H2ЎьЈ«Cl2ЎьЎЈ
ўЫФЪТ»МъЖ¬ЙП¶ЖНӯ,НӯЧчСфј«,МъЧчТхј«УҰУлёәј«ПаБ¬,ЛщТФИфУГёГДЖБтөзіШЧчөзФҙФЪТ»МъЖ¬ЙП¶ЖНӯЈ¬ҙЛМъЖ¬Улёәј«ДЖПаБ¬Ј»ХэИ·ҙр°ё:ДЖЎЈ
ЈЁ2Ј©ўЩХэј«¶юСх»ҜМјөГөзЧУ·ўЙъ»№Фӯ·ҙУҰЈ¬ј«·ҙУҰОӘЈә3CO2Ј«4NaЈ«Ј«4eЈӯ===2Na2CO3Ј«CЈ»ХэИ·ҙр°ёЈә3CO2Ј«4NaЈ«Ј«4eЈӯ===2Na2CO3Ј«CЎЈ
ўЪХэј«·ўЙъј«·ҙУҰОӘ3CO2Ј«4NaЈ«Ј«4eЈӯ===2Na2CO3Ј«CЈ¬ёщҫЭ·ҙУҰ№ШПөҝЙЦӘЈ¬өұЧӘТЖ0.2 mol eЈӯКұЈ¬ёГј«ЦКБҝөДОӘm(Na2CO3)+m(C)=106ЎБ0.1+12ЎБ0.05=11.2 gЈ»ёәј«·ўЙъ·ҙУҰОӘ4Na-4eЈӯ=4NaЈ«Ј¬ёщҫЭ·ҙУҰ№ШПөҝЙЦӘЈ¬m(Na)=23ЎБ0.2=4.6 gЈ»БҪј«өДЦКБҝІоОӘ11.2g+4.6g=15.8gЈ»ХэИ·ҙр°ёЈә15.8ЎЈ



| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВұнОӘЦЬЖЪұнЗ°20әЕФӘЛШЦРДіР©ФӘЛШөДУР№ШКэҫЭЈә
ФӘЛШРФЦК | ўЩ | ўЪ | ўЫ | ўЬ | ўЭ | ўЮ | ўЯ | ўа | ўб | ўв |
ФӯЧУ°лҫ¶ЈЁ10-10mЈ© | 1.86 | 1.52 | 0.66 | 0.53 | 0.77 | 1.10 | 0.99 | 2.31 | 0.70 | 0.64 |
ЧоёЯјЫМ¬ | +1 | +1 | ЎӘЎӘ | +1 | +4 | +5 | +7 | +1 | +5 | ЎӘЎӘ |
ЧоөНјЫМ¬ | ЎӘЎӘ | ЎӘЎӘ | Јӯ2 | -1 | -4 | Јӯ3 | Јӯ1 | ЎӘЎӘ | Јӯ3 | Јӯ1 |
КФ»ШҙрПВБРОКМвЈә(УГ¶ФУҰөДФӘЛШ·ыәЕ»тОпЦКөД»ҜС§КҪұнКҫ)
ЈЁ1Ј©РҙіцўаөДФӯЧУҪб№№КҫТвНјЈә________Ј»
ЈЁ2Ј©ЙПКцўЭЎўўЮЎўўЯәЕФӘЛШЦРДі2ЦЦФӘЛШРОіЙөД»ҜәПОпЦРЈ¬ГҝТ»ёцФӯЧУ¶јВъЧгЧоНвІгОӘ8өзЧУОИ¶ЁҪб№№өДОпЦКҝЙДЬКЗ______Ўў____Ј»
ЈЁ3Ј©ДіФӘЛШRөДФӯЧУ°лҫ¶ОӘ1.04ЎБ10-10mЈ¬ёГФӘЛШФЪЦЬЖЪұнЦРөДО»ЦГКЗ___________ЎЈ
ЈЁ4Ј©ТФЙП10ЦЦФӘЛШөДФӯЧУЦРЈ¬»№ФӯРФЧоЗҝөДКЗ__________ЈЁФӘЛШ·ыәЕЈ©ЎЈ
ЈЁ5Ј©ўЫЎўўЯЎўўЩЎўўвЛДЦЦФӘЛШРОіЙөДАлЧУЈ¬Жд°лҫ¶УЙРЎөҪҙуөДЛіРтОӘ___________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРИЬТәЦРУР№ШОпЦКөДБҝЕЁ¶И№ШПөХэИ·өДКЗ
A. Na2S ИЬТәЦР cЈЁOH©ҒЈ©=cЈЁH+Ј©+cЈЁHS©ҒЈ©+2cЈЁH2SЈ©
B. Na2CO3ИЬТәЦРЈәcЈЁNa+Ј©=2cЈЁCO32©ҒЈ©+2cЈЁHCO3©ҒЈ©
C. КТОВПВЈ¬pH=1өДCH3COOHИЬТәәНpH=13өДNaOHИЬТәөИМе»э»мәПЈ¬ИЬТәЦРАлЧУЕЁ¶ИөДҙуРЎЛіРтЈәcЈЁNa+Ј©ЈҫcЈЁCH3COO©ҒЈ©ЈҫcЈЁOH©ҒЈ©ЈҫcЈЁH+Ј©
D. pH=4өД0.1molL©Ғ1NaHC2O4ИЬТәЦРcЈЁH C2O4©ҒЈ©ЈҫcЈЁH+Ј©ЈҫcЈЁH2C2O4Ј©ЈҫcЈЁC2O42©ҒЈ©
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРОпЦККфУЪ·ЗөзҪвЦКөДКЗЈЁ Ј©
A.¶юСх»ҜМјB.БтЛб粒ММеC.Л®D.ЗвСх»ҜјШИЬТә
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝСЗПххЈВИЈЁClNOЈ©КЗУР»ъәПіЙЦРөДЦШТӘКФјБЎЈҝЙНЁ№э·ҙУҰ»сөГЈә2NO(g)+Cl2(g) ![]() 2ClNO(g)
2ClNO(g)
ЈЁ1Ј©ЗвСх»ҜОпУлРьёЎФЪҙуЖшЦРөДәЈСОБЈЧУПа»ҘЧчУГКұ»бЙъіЙСЗПххЈВИЈ¬Йжј°ИзПВ·ҙУҰЈә
ўЩ2NO2(g)+NaCl(s) ![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
ўЪ4NO2(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
ўЫ2NO(g)+Cl2(g) ![]() 2ClNO(g) K3
2ClNO(g) K3
ФтK3=______________ЈЁУГK1әНK2ұнКҫЈ©ЎЈ
ЈЁ2Ј©°ҙН¶БПұИ[n(NO):n(Cl2)=2:1]°СNOәНCl2јУИлөҪТ»әгС№өДГЬұХИЭЖчЦР·ўЙъ·ҙУҰЈ¬ЖҪәвКұNOөДЧӘ»ҜВКУлОВ¶ИTЎўС№ЗҝPЈЁЧЬС№Ј©өД№ШПөИзНјAЛщКҫЈә
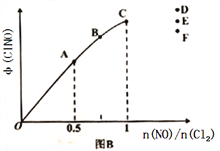
ўЩёГ·ҙУҰөДЎчH______0ЈЁМоЎ°>ЎұЎ°<Ўұ»тЎ°=ЎұЈ©Ј»
ўЪФЪPС№ЗҝМхјюПВЈ¬MөгКұИЭЖчДЪNOөДМе»э·ЦКэОӘ_________Ј»
ўЫИф·ҙУҰТ»ЦұұЈіЦФЪPС№ЗҝМхјюПВҪшРРЈ¬ФтMөгөД·ЦС№ЖҪәвіЈКэKp=__________ЈЁУГә¬PөДұнҙпКҪұнКҫЈ¬УГЖҪәв·ЦС№ҙъМжЖҪәвЕЁ¶ИјЖЛгЈ¬·ЦС№=ЧЬС№ЎБМе»э·ЦКэЈ©ЎЈ
ЈЁ3Ј©Т»¶ЁМхјюПВФЪәгОВәгИЭөДГЬұХИЭЖчЦР°ҙТ»¶ЁұИАэідИлNO(g)әНCl2(g)Ј¬ЖҪәвКұClNOөДМе»э·ЦКэөДұд»ҜНјПсИзНјBЈ¬ФтAЎўBЎўCИэЧҙМ¬ЦРЈ¬NOөДЧӘ»ҜВКЧоҙуөДКЗ_________өгЈ»өұn(NO)/n(Cl2)=1.5КұЈ¬ҙпөҪЖҪәвЧҙМ¬ClNOөДМе»э·ЦКэҝЙДЬКЗDЎўEЎўFИэөгЦРөД_____________өгЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝФЪОЮЙ«ИЬТәЦРЈ¬ПВБРАлЧУДЬҙуБҝ№ІҙжөДКЗЈЁ Ј©
A.Mg2Ј«ЎўSO42ЈӯЎўK Ј«ЎўClЈӯB.NaЈ« ЎўNH4Ј« ЎўNO3ЈӯЎўMnO4Јӯ
C.K Ј« ЎўCu2Ј« ЎўClЈӯЎўBrЈӯD.Ba2Ј« ЎўNaЈ« ЎўNO3ЈӯЎўCO32Јӯ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРұд»ҜЦРЈ¬ұШРлјУИлСх»ҜјБІЕДЬ·ўЙъөДКЗЈЁ Ј©
A.SO2ЎъSB.SO32ЈӯЎъSO2C.IЈӯЎъI2D.KClO3 ЎъO2
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝАыУГФӘЛШөД»ҜәПјЫНЖІвОпЦКөДРФЦККЗ»ҜС§СРҫҝөДЦШТӘКЦ¶ОЎЈИзНјКЗБтФӘЛШөДіЈјы»ҜәПјЫУлІҝ·ЦОпЦКАаұрөД¶ФУҰ№ШПөЈә
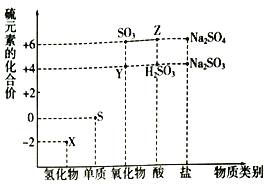
(1)ҙУБтФӘЛШ»ҜәПјЫұд»ҜөДҪЗ¶И·ЦОцЈ¬НјЦРјИУРСх»ҜРФУЦУР»№ФӯРФөД»ҜәПОпУР______________(Мо»ҜС§КҪ)((МоТ»ЦЦҫНҝЙТФ)ЎЈ
(2)Ҫ«XУлY»мәПЈ¬ҝЙЙъіЙөӯ»ЖЙ«№ММеЎЈёГ·ҙУҰЦРСх»ҜјБУл»№ФӯјБөДОпЦКөДБҝЦ®ұИОӘ_______________ЎЈ
(3) ZөДЕЁИЬТәУлНӯөҘЦКФЪТ»¶ЁМхјюПВҝЙТФ·ўЙъ»ҜС§·ҙУҰЈ¬ёГ·ҙУҰөД»ҜС§·ҪіМКҪОӘ____________ЎЈ
(4)Na2S2O3КЗЦШТӘөД»Ҝ№ӨФӯБПЈ®ҙУСх»Ҝ»№Фӯ·ҙУҰөДҪЗ¶И·ЦОцЈ¬ПВБРЦЖұёNa2S2O3өД·Ҫ°ёАнВЫЙПҝЙРРөДКЗ_____________(МоЧЦДё)ЎЈ
aЈ®Na2S+S bЈ®Na2SO3+S cЈ®SO2+Na2SO4 dЈ®Na2SO3+Na2SO4
(5)ТСЦӘNa2SO3ДЬұ»K2Cr2O7Сх»ҜОӘNa2SO4Ј¬Фт24 mL 0.05 mol/LөДNa2SO3ИЬТәУл 20 mL 0.02 mol/LөДИЬТәЗЎәГ·ҙУҰКұЈ¬CrФӘЛШФЪ»№ФӯІъОпЦРөД»ҜәПјЫОӘ____________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ№ШУЪ»ҜС§·ҙУҰөДКөЦКөДЛө·ЁІ»ХэИ·өДКЗ
A. »ҜС§·ҙУҰ¶јУРРВОпЦКЙъіЙ
B. »ҜС§·ҙУҰ¶јУРДЬБҝұд»Ҝ
C. »ҜС§·ҙУҰКЗҫЙјь¶ПБСРВјьЙъіЙөД№эіМ
D. »ҜС§·ҙУҰөД·ўЙъ¶јРиТӘФЪТ»¶ЁМхјюПВ
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com